微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.
请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,A和D反应生成B的化学方程式为______.B的结构式为______.
(2)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,继续灼烧后得到的固体物质成分是______.
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为______.
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂.
①C溶液呈碱性的原因是______.(用离子方程式表示)
②将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小的顺序为______.
参考答案:(1)B和D为空气的主要成分,则为N2和O2,根据A→B→C的反应中都有D参加反应,则D应为O2,B为N2,转化关系为:NH3O2
本题解析:
本题难度:一般
2、简答题 以下各单质和化合物之间存在如图所示的转化关系:
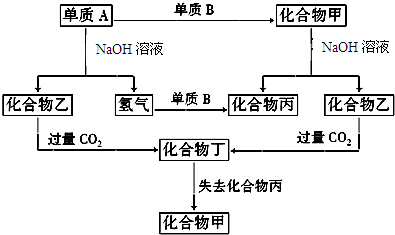
若单质A为非金属:
(1)试确定A、B和乙的化学式:A______,B______,乙______.
(2)写出化合物甲与NaOH溶液反应的化学方程式______.
若单质A为金属:
(3)写出A生成化合物乙的离子方程式______
(4)写出化合物乙与过量CO2反应的化学方程式______
(5)写出化合物丁失去化合物丙的化学方程式______.
参考答案:若单质A为非金属:应为Si,Si和NaOH溶液反应生成Na2SiO3和H2,所以乙是Na2SiO3,Na2SiO3溶液与过量二氧化碳反应生成H2SiO3,即化合物丁为H2SiO3,可失去水生成SiO2,则化合物丙为H2O,化合物甲为SiO2,单质B为O2,
(1)通过以上分析知,A为Si,B为O2,乙为Na2SiO3,故答案为:Si;O2;Na2SiO3;
(2)二氧化硅与氢氧化钠反应生成硅酸钠和水,反应的方程式为SiO2+2NaOH═Na2SiO3+H2O,故答案为:SiO2+2NaOH═Na2SiO3+H2O;
当A是金属时,应为Al,Al和NaOH溶液反应生成NaAlO2和H2,则乙是NaAlO2,NaAlO2溶液与过量二氧化碳反应生成Al(OH)3,即化合物丁为Al(OH)3,失去水可生成Al2O3,也可与氢氧化钠反应,则化合物丙为H2O,化合物甲为Al2O3,单质B为O2,
(3)铝可与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)偏铝酸钠与过量二氧化碳反应生成氢氧化铝和碳酸氢钠,反应的方程式为NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3,
故答案为:NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3;
(5)氢氧化铝可加热分解生成氧化铝,反应的方程式为2Al(OH)3△.Al2O3+3H2O,故答案为:2Al(OH)3△.Al2O3+3H2O.
本题解析:
本题难度:一般
3、填空题 下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质。(反应过程中生成的水及其他产物已略去)
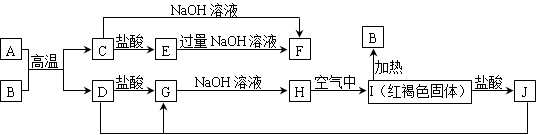
请回答以下问题:
(1)B是_____________,H是_____________(填化学式)
(2)写出J与D反应转化为G的离子方程式_______________________________________
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的离子方程式 _____________
参考答案:(1)Fe2O3(2)Fe(OH)2(3)2Fe3++Fe=3Fe2+(4)2Al+2OH—+2H2O=2AlO2— +3H2↑
本题解析:A为Al,B为Fe2O3,C为Al2O3,D为Fe,G为FeCl2,H为Fe(OH)2,I为Fe(OH)3,J为FeCl3,E为AlCl3,F为NaAlO2。
本题难度:一般
4、填空题 (16分)下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:①反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I
B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
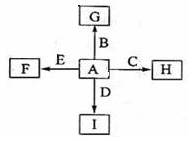
回答问题:
⑴①中反应的化学方程式为??;
⑵化合物I的电子式为??,它的空间结构是??;
⑶1.6gG溶于盐酸,得到的溶液与铜粉完全反应,至少所需的铜粉的质量为?,
⑷C与过量NaOH溶液反应的离子方程为?,反应后的溶液与过量化合物I反应的离子方程式为??;
⑸E在I中燃烧观察到的现象是??。
⑹G的化学式是?。
参考答案:(16分)(1)2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
(2)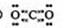 直线形
直线形
(3)铜粉的质量= 0.64g
(4)2Al+2OH-+2H2O=2AlO-2+3H2↑
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(5)镁条剧烈燃烧,生成白色粉末,反应器内壁附有黑色的碳
(6) Fe2O3
本题解析:略
本题难度:一般
5、简答题 A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素.
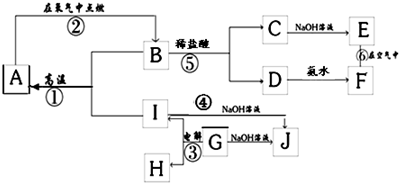
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是______.
(2)检验C溶液中阳离子的方法是(写出操作,现 象及结论)______.
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:______;
反应④的离子方程式:______;
反应⑥的化学方程式:______;
(4)从能量变化的角度看,反应①②③中,属于△H<0的反应是______(填序号).
参考答案:G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3,与NaOH反应生成NaAlO2,而I也能与NaOH反应生成NaAlO2,则I为Al,H为O2,C、D分别和碱反应生成E、F,则说明E、F都为氢氧化物,E能转化为F,应为Fe(OH)2→Fe(OH)3的转化,所以E为Fe(OH)2,F为Fe(OH)3,则C为FeCl2,D为FeCl3,B为Fe3O4,与Al在高温条件下发生铝热反应生成A,即Fe,
(1)A、B、C、D、E、F六种物质中所含的同一种元素是Fe元素,铁元素位于第四周期第Ⅷ族,故答案为:第4周期Ⅷ族;
(2)C是氯化亚铁,亚铁离子不稳定易被氧化生成铁离子,铁离子能和硫氰化钾溶液发生反应生成络合物而使其溶液呈血红色,所以检验亚铁离子的方法是:取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+,
故答案为:取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+;
(3)高温下,铝和四氧化三铁反应生成氧化铝和铁,反应方程式为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe,
铝和氢氧化钠反应生成偏铝酸钠和氢气,其离子反应方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe、2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)铝热反应和燃烧反应都是放热反应,故选①②.
本题解析:
本题难度:一般