微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 .已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.第一电离能:Y可能大于或小于X
B.气态氢化物的稳定性:HmY强于HnX
C.最高价含氧酸的酸性X强于Y
D.X和Y形成化合物时,X显负价Y显正价
参考答案:B
本题解析:略
本题难度:一般
2、选择题 第三周期R元素的原子,其次外层的电子数为最外层电子数的2倍,则R是
A.Li
B.S
C.Si
D.P
参考答案:C
本题解析:考查原子核外电子的排布规律。第三周期元素的次外层含有8个电子,所以R的最外层电子数是4,则原子序数为14,即R是硅元素。答案选C。
本题难度:一般
3、选择题 某元素原子的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是(?)
A.14
B.15
C.16
D.17
参考答案:A
本题解析:考查原子核外电子的排布规律,根据排布规律可知,K、L分别有2、8个电子,所以质子数是14,答案选A。
本题难度:简单
4、选择题 第二周期元素R,它的最外电子层达到稳定结构所需电子数小于最外层达到稳定结构时的电子数和最内层电子数之差,并且等于最内层电子数的整数倍。则关于R的正确说法是( )。
A.常温下能稳定存在的R的氧化物都能和烧碱溶液起反应
B.R最高价氧化物对应水化物都是强酸
C.R的最简单氢化物可能有两种,其稳定性一种比NH3强,另一种比NH3弱
D.R的最简单氢化物受热时都易分解
参考答案:C
本题解析:依题意,设R原子的最外层电子数为x,因为最外层达到稳定结构时的电子数是8,所以,达到稳定结构时所需的电子数为(8-x)。由于R是第二周期的元素,其原子的最内层电子数是2,所以
8-x<8-2=6,x>2 ①
8-x=2n ②(n是正整数)
由①和②得,2n<6,n<3,即n=1或n=2,故x=6或4,R可能是氧元素或碳元素。常温下能稳定存在的碳的氧化物有CO和CO2,但CO不能与烧碱溶液反应,选项A不正确。碳的最高价氧化物是CO2,对应的水化物碳酸是弱酸,选项B不正确。R的最简单氢化物可能有两类,即甲烷(CH4)和水(H2O),根据同一周期元素性质的递变规律推知,H2O的稳定性比NH3强,NH3的稳定性比CH4强,选项C正确。CH4在较高温度下才能分解,H2O在加热时很难分解,选项D不正确。
本题难度:简单
5、填空题 (15分)下表是元素周期表的一部分。
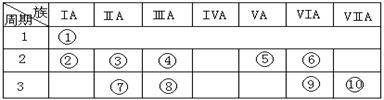
⑴下列说法正确且能说明元素⑩的非金属性比元素⑨强的是 。
A.同温同压下,元素⑩的气态氢化物溶解度大于元素⑨的气态氢化物
B.元素的最高价氧化物对应的水化物的酸性⑩强于⑨
C.元素⑨和⑩的单质与铁反应分别得到低价、高价铁的化合物
D.元素⑩的电负性大于元素⑨
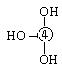 则可判断该酸为 酸(填强或弱)
则可判断该酸为 酸(填强或弱)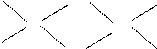 Cl? Cl? Cl
Cl? Cl? Cl