微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (本题共12分)
我国钾长石(KAlSi3O8)的资源比较丰富。工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l) +KAlSi3O8 (s)  ?KCl (l)+NaAlSi3O8 (s)。
?KCl (l)+NaAlSi3O8 (s)。
完成下列填空:
(1)硅原子的最外层电子占据了?个轨道,有?种能量。
(2)氯化钠的熔点比氯化钾的?(填“高”或“低”),原因是?。
(3)把反应中涉及到的六种元素的原子半径按从小到大的顺序排列?。
(4)参与上述反应且位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素是?。
(5)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
?时间(h)
钾元素
温度?熔出率
| 1.5
| 2.5
| 3.0
| 3.5
| 4.0
|
830℃
| 0.481
| 0.575
| 0.626
| 0.669
| 0.685
|
890℃
| 0.579
| 0.691
| 0.694
| 0.699
| 0.699
|
950℃
| 0.669
| 0.714
| 0.714
| 0.714
| 0.714
|
?
①分析数据可以得出,该制备氯化钾的反应是?(填“放热”或“吸热”)反应。
②计算890℃时,氯化钠的平衡转化率?。(式量:KAlSi3O8–278? NaAlSi3O8 –262)
③950℃时,提高熔出钾的速率可以采取的措施是?(写出两种)。
参考答案:(1)3? 2
(2)高?钾离子半径大于钠离子,半径越大,离子键键能越低,熔点越低。
(3)O<Cl<Si<Al<Na<K
(4)Na
(5)①吸热 ②0.074 ③充分搅拌?将钾长石充分粉碎
本题解析:(1)硅原子的最外层电子排布式为3S23P2占据了3个轨道,有2种能量。
(2)钾离子半径大于钠离子,半径越大,离子键键能越低,熔点越低。氯化钠的熔点比氯化钾的高。
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,故原子半径K>Na>Al>Si>Cl>O。
(4)Na、Al、Si、Cl四种元素处于同一周期,氢氧化钠能与氢氧化铝、硅酸、高氯酸反应生成相应的盐与水,故答案为:Na;
(5)①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,升高温度平衡向吸热方向移动,故正反应为吸热反应,故答案为:吸热;② 1gKAlSi3O8 (s)中K的质量为:39/278=0.140g,
NaCl (l) +KAlSi3O8 (s)  ?KCl (l)+NaAlSi3O8 (s)。
?KCl (l)+NaAlSi3O8 (s)。
开始? 2g? 1g? 0
平衡? 0.699*74.5*0.140/39
转化? 0.699*74.5*58.5*0.140/39*74.5? 0.699*74.5/39
求得 0.699*74.5*58.5*0.140/39*74.5 =0.148,氯化钠的平衡转化率=0.148/2=0.074。
③950℃时,提高熔出钾的速率可以采取的措施是充分搅拌,反应物充分接触,反应速率加快,或将钾长石粉粹成更小的颗粒,增大反应物的接触面积,反应速率加快。
本题难度:一般
2、选择题 已知丙酮通常是无色的液体,易溶于水,密度小于1 g·mL-1,沸点约为55℃.要从水与丙酮的混合物里将丙酮分离出来,下列方法最合理的是
A.蒸馏
B.分液
C.过滤
D.蒸发
参考答案:A
本题解析:易溶于水,沸点低的特点适于蒸馏分离.
本题难度:一般
3、选择题 同温同压同体积的两个密闭容器中分别充满12C18O和14N2两种气体。关于这两个容器中气体的说法正确的是()
A.质子数相等,质量不等
B.分子数和质量都不相等
C.分子数和质量都相等
D.原子数和中子数都相等
参考答案:A
本题解析:根据阿伏加德罗定律,同温同压同体积的12C18O和14N2具有相同的分子数,而12C18O和14N2每个分子中都含14个质子,故质子数也相等,但因为二者的相对分子质量不同,故质量不同。
本题难度:简单
4、选择题 A、B、C均为短周期元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.C元素的最高正价为+7价? B.原子半径:A>B>C
C.离子半径:A2->C->B2+? D.原子序数: B > A >C
参考答案:C
本题解析:A、C的最低价阴离子分别为A2-、C-,则AC分别属于第ⅥA和第ⅦA。又因为B2+与C-具有相同的电子层结构,且A、B同周期,所以A是硫,B是镁,C是氟。F元素没有最高正价,A项错误;原子半径是B>A>C,B项错误,原子序数A > B > C,D项错误。答案选C。
点评:本题属于简单题,是学生需要熟练掌握的关于元素周期律的规律。要把这几种未知元素推出来就可以分析判断。
本题难度:一般
5、填空题 (7分)短周期元素A、B、C、D,其离子半径逐渐增大,它们的原子中核外都有一个未成对电子。已知A和D处于同一周期,0.2摩尔A单质可以从D的氢化物的水溶液中置换出6.72 L氢气(标准状况),试回答:
(1) A、B、C、D元素分别是A:?,B:?,C:?,D:?。
(2)比较C和D的氢化物(用分子式表示):
稳定性?>?,水溶液的酸性?> ?
(3)用电子式表示化合物BD的形成过程?
参考答案:(1)Al Na F Cl
HF>HCl HCl>HF (3)略
本题解析:(1)6.72 L氢气(标准状况)的物质的量为0.3mol,即0.2摩尔A与D的氢化物的水溶液反应失去0.6mol电子,得A元素的化合价为+3价,所以可知A元素为AL元素。又因为A、B、C、D原子中核外都有一个未成对电子,B为Na元素,C为F元素,D为CL元素。
(2)C和D的氢化物分别为:HF、HCL,由于CL的非金属性小于F的非金属性,所以其稳定性关系为:HF>HCl;HF酸为弱酸HCL酸为强酸,所以水溶液的酸性强弱为:HCl>HF
(3)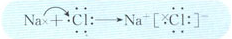
本题难度:简单