微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电子式中错误的是( )
A.Na+
B.
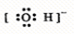
C.
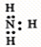
D.
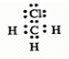
参考答案:C
本题解析:
本题难度:一般
2、简答题 A、B、C、D都是短周期元素,原子半径D>C>A>B.其中A、B处于同一周期,A、C处于同一主族.C原子核内的质子数等于A、B原子核内质子数之和,C原子最外层电子数是D原子最外层电子数的4倍.
(1)写出C元素在周期表的位置:第______周期______族
(2)A与B形成的三原子分子的结构式:______.
(3)C的氧化物和D的最高价氧化物对应水化物反应的离子方程式为:______.
参考答案:据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为:
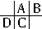
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D的最外层电子数为1符号题意,故D为钠,C为硅,A为碳,则
(1)C为Si元素,原子序数为14,原子核外有3个电子层,最外层电子数为4,应位于周期表第三周期、ⅣA族,
故答案为:三;ⅣA;
(2)A与B形成的三原子分子为CO2,为直线形分子,结构式为O=C=O,故答案为:O=C=O;
(3)SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O.
本题解析:
本题难度:一般
3、填空题 有V、W、X、Y、Z五种短周期元素,原子序数依次增大.X是短周期中原子半径最大的主族元素,V的单质常温常压下最轻的气体,V和W可以形成V2W和V2W2两种化合物,W和Z为同主族元素,Y最外层电子数与电子层数相等.
(1)五种元素中按照主族归类,无同一主族元素的是______;
(2)W和X形成原子个数比为1:1的化合物的电子式为______;
(3)已知V有三种常见同位素(zzV、zz+1V、zz+2V),W有常见的两种同位素(a2aW、a2a+2W)则V2W分子有______种,这些分子的相对分子质量有______种不同数值;
(4)Z的单质有Z2、Z4、Z6、Z8等形式,它们之间的关系属于______;
(5)最近日本福岛核电站泄漏的放射性核素铯-137,它的原子序数为55,铯位于元素周期表第____ __周期第______族;
(6)V、W、X、Z可以形成含有相同四种元素且能相互反应的两种化合物,该反应的离子方程式为______.
参考答案:由X是短周期中原子半径最大的主族元素,则X为钠;V的单质常温常压下最轻的气体,则V为氢;V和W可以形成V2W和V2W2两种化合物,则W为氧;W和Z为同主族元素,则Z为硫;V、W、X、Y、Z五种短周期元素,原子序数依次增大,且Y最外层电子数与电子层数相等,则Y为第三周期第ⅢA族元素,即Y为铝,
(1)V、W、X、Y、Z分别为H、O、Na、Al、S,因H与Na同主族,O与S同主族,只有Al无同一主族元素,故答案为:Y或Al;
(2)W和X形成原子个数比为1:1的化合物为Na2O2,其电子式为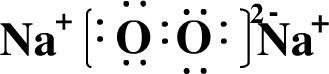 ,
,
故答案为: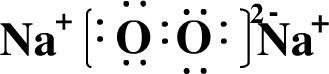 ;
;
(3)H有3种核素,O有2种核素,则V2W分子中有2个H原子和1个O原子,则水有3×2×2=12种,根据相对原子质量计算相对分子质量,存在7种不同的相对分子质量,
故答案为:12;7;
(4)由同种元素组成的不同单质互为同素异形体,故答案为:同素异形体;
(5)Cs的原子序数为55,各层的电子数分别为2、8、18、18、8、1,有6个电子层、最外层电子数为1,则在第六周期第ⅠA族,故答案为:第六周期;ⅠA族;
(6)V、W、X、Z可以形成含有相同四种元素且能相互反应的两种化合物为NaHSO4和NaHSO3,HSO3-为弱酸根离子,
则离子反应为HSO3-+H+=SO2↑+H2O,故答案为:HSO3-+H+=SO2↑+H2O.
本题解析:
本题难度:一般
4、选择题 判断下列有关化学基本概念的依据正确的是
[? ]
A.溶液与胶体本质的不同是能否发生丁达尔效应
B.共价化合物:是否含有共价键
C.强、弱电解质:溶液的导电能力大小
D.氧化还原反应:元素化合价是否变化
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
[? ]
A.NH4Cl NH3↑ + HCl↑
NH3↑ + HCl↑
B.NH3 + CO2 + H2O == NH4HCO3
C.2NaOH + Cl2 == NaCl + NaClO + H2O
D.2Na2O2 + 2CO2 == 2Na2CO3 + O2
参考答案:D
本题解析:
本题难度:简单