微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白
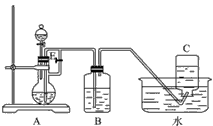
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_________,A中反应的离子方程式是
____________________________________。
(2)实验开始时应先将活塞E_________(填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是______________。
(3)关闭活塞E及分液漏斗上的活塞加入适量硫酸,硫酸与铁屑接触后产生气体。待收集到足量气体后关闭活塞E,现象是____________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________________。
2、实验题 在如图所示的实验装置中,当A、B、C分别为以下不同组合时,回答有关问题。
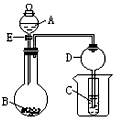
(1)当A为盐酸、B为贝壳(粉末)、C为水玻璃时,小试管中的现象是________________,其中发生的离子反应方程式是________________。
(2)当A为浓氨水、B为生石灰、C为AlCl3溶液,小试管中出现的现象是________________,反应的离子方程式为________________。
(3)当A为浓硫酸、B为Mg、Al、Fe、Cu中的一种银白色片状金属、C为品红溶液,小试管中溶液红色褪去,则B为 (填元素符号), A和B反应的方程式是________________。
(4)装置D的作用是________________。
3、实验题 聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
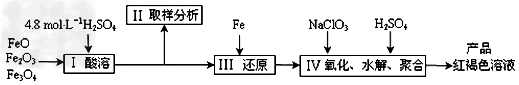
(1)实验室用18.4?mol·L-1的浓硫酸量取_______mL来配制250mL4.8?mol·L-1的硫酸溶液,所用的仪器除烧杯、玻璃棒和移液管外,还需要的玻璃仪器_____________。
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是_____________。
A.控制溶液中Fe2+与Fe3+含量比?
B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量?
D.确保铁的氧化物酸溶完全
(3)①写出步骤Ⅳ中用NaClO3氧化时的离子方程式____________________(提示:ClO3-转化为Cl-);
②已知1mol?HNO3的价格为0.16元,1mol?NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是__________,弊是____________。
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+?物质的量之比,有人设计了以下操作
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m?g。
(b)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000?mol/L?KMnO4标准溶液VmL。离子方程式为:5Fe2+?+?MnO4-+?8H+?=?5Fe3+?+?Mn2+?+?4H2O
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是__________________;?
②在(b)步骤中判断达到终点的现象是_______________;
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为____________(用含m、V的代数式表示)。
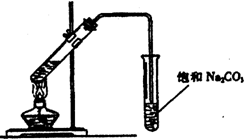
4、简答题 实验室用如图所示装置制取乙酸乙酯.
(1)装置中通有蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是:______;
(2)饱和Na2CO3溶液的作用是:______;
(3)实验生成的乙酸乙酯,其密度比水______.(填“大”或“小”);
(4)分离乙酸乙酯和饱和Na2CO3溶液所需要的主要仪器是:______.
5、填空题 铁强化酱油是在酱油添加食品强化剂--乙二胺四乙酸铁钠盐,乙二胺四乙酸铁钠盐化学式为:
C10Hl2FeN2NaO8·3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇。l%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下
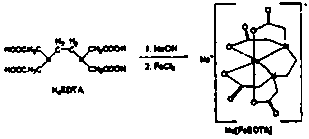
实验室制备NaFeEDTA·3H2O步骤如下:
①把0.4g(0.0lmol)NaOH溶于l0mL蒸馏水,然后再加入3.8g(0.01mo1)Na2H2EDTA·2H2O,把溶液微热,直至固体完全溶解。
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3·6H2O。称取2.5g(0.009mol)FeCl3·6H2O溶予5mL,蒸馏水中(并加l滴盐酸)。
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出。
⑤冷却、减压过滤,先用冰水洗涤樗用乙醇洗涤。
⑥将固体凉干,称得制得的淡黄色粉末2.8g
试回答下列问题
(1)在步骤①中,须加入过量的碱,是因为_________________。
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是___________________________;加显色利后分别发生反应的离子方程式为_______________________;_________________________。
(3)步骤⑤中用冰水和乙醇洗涤的目的是,_________________,_________________。
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是:__________________________________。
(5)检验某品牌酱油中是否加有NaFeEDTA·3H2O,先取20mL酱油加入10rnL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是_________________(写化学式)。
(6)本次实验的NaFeEDTA·3H2O的实际产率为:_________________。