微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
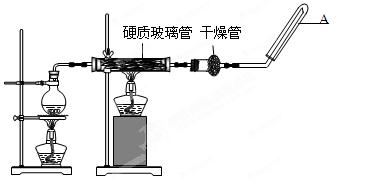
(1)写出该反应的反应方程式? ?;
?; 并指明该氧化还原反应的还原剂是?,氧化剂是?。
并指明该氧化还原反应的还原剂是?,氧化剂是?。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是??;烧瓶底部放置了几片碎瓷片,其作用是? ?。
(3)试管中收集气体是?,如果要在A处玻璃管处点燃该气体,则必须对该气体进行?。
参考答案:.(15分)
(1)? 3Fe+ 4H2O(气)= 高温= Fe3O4+ 4 H23分,以下空各2分?Fe???H2O

本题解析:略
本题难度:一般
2、选择题 将18g铜和铁的混合物投入200mL稀硝酸中,充分反应后得到标准状况下2.24LNO,剩余9.6g金属;继续加入200mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24LNO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
A.原混合物中铜和铁各0.15mol
B.稀硝酸的物质的量浓度为1mol/L
C.第一次剩余的9.6g金属为铜和铁
D.再加入上述200mL稀硝酸,又得到标准状况下2.24LNO
参考答案:溶液不变红,即反应是恰好完全反应,既没有三价铁离子,也没有硝酸剩余.可以看作是18g混合物质与400ml硝酸反应生成0.2mol NO.铁铜全都生成二价的离子,设铁为A mol,铜为Bmol,发生的反应离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;列两个方程:
56A+64B=18、2A/3+2B/3=0.2.
解得:A=0.15mol、B=0.15mol? 计算得到18g混合物中含铁质量为0.15mol×56g/mol=8.4g;
含铜质量为0.15mol×64g/mol=9.6g;
A、原混合物中铜和铁各0.15mol,故A正确;
B、硝酸浓度为:C(HNO3)=0.8mol/0.4L=2mol/L;稀硝酸的物质的量浓度为2mol/L,故B错误;
C、第一次剩余金属9.6g,通过上述计算得到为铜,故C错误;
D、溶液中二价铁离子为0.15mol,所以再加硝酸得NO为0.05mol即11.2L,故D错误;
故选A.
本题解析:
本题难度:一般
3、计算题 (8分)黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m?g?X粉末全部溶于200?mL的浓HNO3,反应后的溶液加水稀至?2.12?L时测得其pH=0;将稀释后的溶液分为两等份,向其中一份溶液中滴加浓度为6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶
05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶 液的体积变化如下图所示:
液的体积变化如下图所示:

(1)请通过计算确定:m=________。
(2)X的摩尔质量为368 g/mol,则X的化学式为________________。
(3)将一定质量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分别加入同浓度的稀硝酸 ,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
实验编号
| ①
| ②
| ③
| ④
|
稀硝酸体积/mL
| 100
| 200
| 300
| 400
|
剩余金属质量/g
| 9.0
| 4.8
| 0
| 0
|
NO体积/L
| 1.12
| 2.24
| 3.36
| V
|
回答下列问题:
①写出实验①中发生反应的离子方程式___________________________________。
②实验④中V=________。
参考答案:(8分)
(1)解:依题意,m?g?X中:n(Cu)∶n(F e)=1∶1
e)=1∶1
2n(Cu2+)+3n(Fe3+)=6.05mol·L-1×0.2 L×2-1 mol·L-1×2.12 L
故:n(Cu)=n(Fe)=0.06 mol
又,n?(S)=0.6 mol·L-1×0.1 L×2?=?0.12 mol
因此:m?g=m(Cu)+m(Fe)+m(S)=0.06 mol×64g·mol-1+0.06 mol×56 g·mol-1+0.12 mol×32 g·mol-1=11.04 g(?即m?的值为11.04)
(2)解:设X的化学式为(CuFeS2)n,则?(64+56+32×2)×n?=3 68,n=2;故X的化学式为Cu2Fe2S4
68,n=2;故X的化学式为Cu2Fe2S4
(3)① 3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O ② V=4.48 L
本题解析:略
本题难度:困难
4、选择题 1 L含有HNO3、Fe(NO3)3、Cu(NO3)2三种溶质的溶液,三者的物质的量浓度之比为4:1:1,慢慢向其中加入铁粉,以下图像正确的是(横坐标表示加入Fe的物质的量,单位:mol;纵坐标表示Fe2+的物质的量浓度,单位:mol/L)
[? ]
A.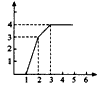
B.
C.
D.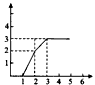
参考答案:A
本题解析:
本题难度:一般
5、实验题 (19分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
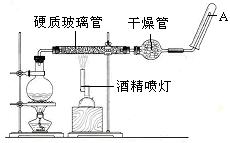
(1)写出该反应的化学方程式?,其中氧化剂是?,还原剂是?。8.4g铁粉参加反应,转移电子?mol。
(2)玻璃管中石棉绒的作用是?,实验开始时应先点燃?,实验结束时应先熄灭?。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是??;烧瓶里应事先放置?,其作用是?。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的
成分是?,若溶液未变红色则说明硬质试管中固体物质的
成分是?。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是?
?(用离子方程式表示)。

(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按上图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关
的反应的化学方程式??,
?。
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有?性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是?,
并且配制含Fe2+的盐溶液时应加入少量?。
参考答案:(1)3Fe+4H2O(g)  Fe 3O4 +4 H2(不写(g)或“加热”扣1分,写成“高温”不扣分)
Fe 3O4 +4 H2(不写(g)或“加热”扣1分,写成“高温”不扣分)
H2O? Fe? 0.4
(2)铁粉的载体,增大铁粉与水蒸气的接触面积?酒精灯?酒精喷灯
(3)为实验提供水蒸气?碎瓷片?防止暴沸
(4)一定有Fe3O4,可能有Fe(各1分)? Fe3O4和Fe
(5)Fe + 2Fe3+= 3Fe2+?
(6)FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4(1分)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(1分)
(7)还原?Fe2+易被空气中的氧气氧化而变质?铁粉
本题解析:略
本题难度:一般