微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分是次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH?处理Cl2?和HCl?废气
D.Al2(SO4)3?可除去碱性废水及酸性废水中的悬浮颗粒
参考答案:A.漂白粉的主要成分是氯化钙、次氯酸钙,有效成分为次氯酸钙,故A错误;
B.浓硫酸与氨气反应,则实验室不可用浓硫酸干燥氨气,故B错误;
C.氯气、HCl与NaOH都反应,则实验室可用NaOH?处理Cl2和HCl废气,故C正确;
D.酸性废水中Al2(SO4)3?无法得到胶体,胶体能除去废水中的悬浮颗粒,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 如图1-2-1所示,从A处通入新制的氯气,关闭活塞B时, C处的红色布条看不到明显变化;当打开活塞B时;C处的红色布条逐渐褪色。则D瓶中装有的试剂可能是
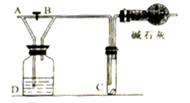
A.浓硫酸
B.盐酸溶液
C.水
D.饱和食盐水
参考答案:A
本题解析:从A处通入新制的氯气,关闭活塞B时,则氯气将进入溶液D中。而 C处的红色布条看不到明显变化,说明溶液D能吸收或干燥氯气。浓硫酸能干燥氯气,其余都是不能的,所以选项A正确,答案选A。
本题难度:一般
3、简答题 化学在生产和日常生活中有广泛的应用.下列说法不正确的是( )
A..红宝石、蓝宝石和金刚石都是由碳元素组成的宝石
B.家中发生天然气泄露时,不能使用室内电话报警
C.氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全地带
D.漂白粉与洁厕精不能混合使用,否则易产生有毒气体
参考答案:A、红宝石、蓝宝石的主要成分都是Al2O3,金刚石的成分是C,故A错误;
B、天然气的主要成分是甲烷,遇明火会爆炸,所以家中发生天然气泄露时,不能使用室内电话报警,故B正确;
C、肥皂水呈碱性,可与氯气反应降低毒性,所以氯气泄露时,可用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全地带,故C正确;
D、漂白粉的主要成分为次氯酸钠,洁厕精的主要成分是浓盐酸,两者相遇会产生有毒气体氯气,故D正确;
故选A.
本题解析:
本题难度:一般
4、简答题 (1)某学习小组利用下图装置制取氯气并探究其性质.
①甲装置中反应的化学方程式是______;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)______;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质.已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是______.
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究.
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol?L-1盐酸、品红溶液、新制澄清石灰水.
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含______;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3.
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论
①
用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管______
若无气体放出且澄清石灰水未见浑浊,则假设一成立;______
②
______
______
|
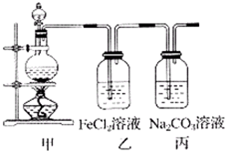
参考答案:(1)①浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应的化学方程式为MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
②氯化铁和氯气反应,2FeCl2+Cl2=2FeCl3,三价铁离子和硫氰酸钾反应生成血红色溶液,Fe3++3SCN-=Fe(SCN)3,故答案为:KSCN,溶液变为血红色;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以方程式为Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3,故答案为:Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3.
(2)漂白粉的主要成分为CaCl2、Ca(ClO)2,Ca(ClO)2易与空气中二氧化碳和水反应生成HClO,HClO不稳定,见光分解生成HCl和水,最终生成CaCl2、CaCO3;
如漂白粉没有变质,则漂白粉中无CaCO3,加入盐酸后无气体放出且澄清石灰水未见浑浊;
如漂白粉全部变质,则产物为CaCl2、CaCO3,取少量样品于试管中,加入足量的稀盐酸,并将所得气体依次通入品红溶液和澄清石灰水,则品红不褪色,而石灰水变浑浊;
如漂白粉部分变质,漂白粉中含有CaCl2、Ca(ClO)2、CaCO3,取少量样品于试管中,加入足量的稀盐酸,并将所得气体依次通入品红溶液和澄清石灰水,品红溶液褪色,澄清石灰水变浑浊,
故答案为:CaCl2、CaCO3;
实验步骤预期现象和结论①再向B试管加入1mol/L的稀盐酸加入适量1mol/L的盐酸,塞上带导管的单孔塞,将导管的另一端插入A试管中若有气泡冒出,且澄清石灰水变浑浊则假设一步成立,假设二、三成立②用胶头滴管向上述步骤后的B试管中滴入几滴品红试液,振荡若品红溶液不褪色,则假设二成立,若品红溶液褪色,则假设三成立
本题解析:
本题难度:一般
5、简答题 (1)在一密闭容器中盛有aLCl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为aL.用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余.由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是______.
A.Cl2:H2=1B.Cl2:H2<1C.Cl2:H2≥1D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收.
①求原NaOH溶液的质量分数.(结果用小数表示,保留3位小数)
②求所得溶液中Cl-与ClO-的物质的量之和.
③求溶液中ClO-的物质的量.
参考答案:(1)因Cl2+H2点燃.2HCl,反应前后体积不变,
用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余,
氢气与碱不反应,而氯气与碱反应,
则氯气的体积一定大于氢气的体积,
即Cl2:H2≥1,
故选C;
(2)①溶液的质量m=ρV=1.12g/mL×200mL=224g,溶质的质量m=CVM=3.00mol/L×0.2L×40g/mol=24g,所以其质量分数=24g224g×100%=10.7%,
答:氢氧化钠溶液的质量分数是10.7%;
②氯气和氢气生成的氯化氢和氢氧化钠反应生成氯化钠,氯气和氢氧化钠反应生成氯化钠和次氯酸钠,2NaOH+Cl2=NaCl+NaClO+H2O、NaOH+HCl=NaCl+H2O知,n(Cl2)=12n(NaOH)=12×3.00mol/L×0.2L=0.3mol,再根据原子守恒知,所得溶液中Cl-与ClO-的物质的量之和=2 n(Cl2)=0.6mol,
答:所得溶液中Cl-与ClO-的物质的量之和为0.6mol;
③根据H2+Cl2点燃.2HCl、2NaOH+Cl2=NaCl+NaClO+H2O、NaOH+HCl=NaCl+H2O知,有一半的氯气和氢氧化钠反应生成氯化钠和次氯酸钠,氯气和氢氧化钠的反应中有一半的氯气生成次氯酸钠,所以一共有14的氯气生成次氯酸钠,则溶液中ClO-的物质的量=14n(Cl2)=0.15mol,
答:溶液中ClO-的物质的量是0.15mol.
本题解析:
本题难度:一般