微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:
NaHCO3+H2 HCOONa+H2O,下列有关说法不正确的是(? )
HCOONa+H2O,下列有关说法不正确的是(? )
A.储氢、释氢过程均有能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被还原
D.释氢过程中,每消耗0.1mol H2O放出2.24L的H2
参考答案:D
本题解析:A.无论是储氢还是释氢过程都有化学键的断裂和生成,短化学键吸收能量,形成化学键放出能量。因此均有能量变化。正确。B.NaHCO3、HCOONa都是离子化合物,含有离子键,在酸根离子中都含有极性共价键。因此它们均含有离子键和共价键。正确。C.储氢过程中,H2失去电子,被氧化,NaHCO3得到电子被还原。正确。D.释氢过程中,每消耗0.1mol H2O放出0.1mol的氢气。在标准状态下 其体积为2.24L.错误。
本题难度:一般
2、选择题 下列表示溶液中发生反应的化学方程式错误的是
[? ]
A.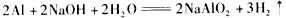
B.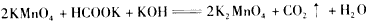
C.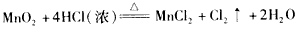
D.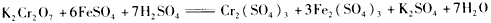
参考答案:B
本题解析:
本题难度:一般
3、选择题 需要加入氧化剂才能实现的变化是
A.MnO2→MnSO4
B.AlCl3→Al(OH)3
C.KI→KIO3
D.HNO3→NO
参考答案:C
本题解析:需要加入氧化剂才能实现,说明该物质具有还原性,在反应中化合价要升高。符合条件的为C,所以选C。
本题难度:简单
4、填空题 氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
完成下列填空:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前
①用0.1mol·L-1H2SO4(aq)洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;
②将KNO3(aq)的pH调至2.5;
③为防止空气中的 (写化学式)对脱氮的影响,应向KNO3溶液中通入N2。
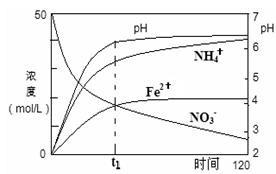
(2)用足量Fe粉还原上述KNO3(aq)过程中,反应物与生成物的离子浓度、pH随时间的变化关系如图所示。请根据图中信息写出t1时刻前该反应的离子方程式: 。
(3)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为 。如果反应中有5mol电子发生转移,可得到肼 g。
(4)常温下向25mL 0.01mol/L稀盐酸中缓缓通入5.6 mL NH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是 。在通入NH3的过程中溶液的导电能力 (填写“变大”、“变小”或“几乎不变”)。
(5)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是 (选填编号)。
a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡 (填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为 mol·L-1。
参考答案:(1)去除铁粉表面的氧化物等杂质 (1分)、 O2(1分)
(2)4Fe+NO3—+10H+→4Fe2++NH4++3H2O(2分,物质正确写全1分,配平1分)
(3)2:1(1分)、80(1分)
(4)c(Cl-)>c(NH4+)>c(H+)>c(OH-)(1分)、几乎不变(1分)。
(5)ac(2分,每个1分)
(6)先正向移动,后逆向移动(1分)、0.4mol/L(1分)。
本题解析:(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前①用H2SO4(aq)洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质如铁锈。③由于二价铁离子易被空气中的氧气氧化会对脱氮的影响,应向KNO3溶液中通入N2可以进行隔绝。
(2)由图中信息可以看出氢离子浓度减小,硝酸根浓度减小,二价铁离子浓度增大,铵根离子浓度增大,可以确定出反应物和生成物,并运用氧化还原反应原理得出t1时刻前该反应的离子方程式:4Fe+NO3—+10H+→4Fe2++NH4++3H2O。
(3)根据得失电子数相等,NH3----N2H4与NaClO---Cl-,该反应中被氧化(N)与被还原的元素的原子(Cl)个数之比为2:1。如果反应中有5mol电子发生转移时生成肼2.5mol,质量为80g。
(4)25mL 0.01mol/L稀盐酸物质的量是0.00025mol,5.6 mL NH3(标准状况)物质的量为0.00025mol,反应后恰好生成氯化铵,水解后呈酸性,其溶液中离子浓度由大到小的顺序是c(Cl-) >c(NH4+) >c(H+)> c(OH-) 。在通入NH3的过程中由于生成了一水合氨是弱电解质,产生的离子很小,溶液的导电能力几乎不变。
(5)向上述溶液中继续通入NH3,溶质为氯化铵和一水合氨,过程中溶液会呈中性,最终溶液呈碱性,所以该过程中离子浓度大小关系可能正确的是 a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) 呈中性;c.c(NH4+)>c(OH-)>c(Cl-)>c(H+)呈碱性;
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水时生成了铵根离子降低了溶液中的氢离子浓度此时平衡先正向移动,当盐酸反应完后溶液呈碱性时又对水的电离起到了抑制作用,使水的电离平衡逆向移动。当滴加氨水到25mL时,测得溶液中水的电离度最大说明恰好生成了氯化铵此时氨气的物质的量和氯化氢的物质的量相同都为0.01mol,则氨水的浓度为0.01/0.025=0.4mol/Lmol·L-1。
考点:本题考查了盐类水解,电离平衡及化学图像识别等知识。
本题难度:困难
5、选择题 下列化学用语使用正确的是
A.Mg2+结构示意图: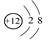
B.含18个中子的氯原子的核素符号: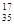 Cl
Cl
C.苯甲醛: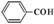
D.水合氢离子电子式: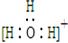
参考答案:A
本题解析:A、Mg2+核外电子数为10,结构示意图正确;B、质子数在元素符号的左下方、质量数在元素符号的左上方,错误;C、醛基的结构简式为—CHO,错误;D、水和氢离子中,O与3个H形成了3个共价键,O还有1对孤对电子,错误。
本题难度:一般