微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 含硫化氢的工业废气要经过治理方能排放,既回收硫单质又防止大气污染.请根据如下治理方法回答相关问题.
(1)电解法治理硫化氢的工艺流程如下:
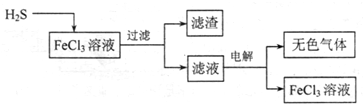
①FeCl3溶液吸收H2S的生成物是______
②用惰性电极电解滤液时,阴极的电极反应式为______,电解总反应的离子方程式是______
(2)富玛克斯法治理硫化氢的方法和步骤如下:
a.用2%?3%的Na2CO3溶液吸收含H2S的废气,反应生成2种酸式盐;
b.向上述反应所得溶液中加入液体R-NO(R表示一种芳香烃基),发生如下反应:R-NO+NaHS+H2O→R-NHOH+NaOH+S↓
C.步骤b生成的NaOH在溶液中与另一种酸式盐反应生成正盐;
d.R-NHOH与空气中的氧气反应又得到R-NO.
①写出上述a、c两步反应的离子方程式______、______.
②在上述治理硫化氢的全过程中,总反应的化学方程式是______,若某工厂每天需要处理含H2S?10%的废气1800m3,在步骤d中理论上消耗空气______m3(空气中O2的体积百分含量以20%计算,所有气体体积均在标准状况下测得).
(3)上述两种治理方法的共同优点是______.
参考答案:(1)①三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应,2FeCl3+3H2S=2FeCl2+6HCl+3S↓,故答案为:FeCl2、HCl和S(或答氯化亚铁、盐酸和硫单质);
②电解氯化亚铁时,阴极发生氢离子得电子的还原反应,2H++2e-═H 2↑,阳极亚铁离子发生失电子的氧化反应,2Fe2+═2Fe3++2e-,根据两极反应可写总的电解反应为:2Fe2++2H+?电解?.?2Fe3++H 2↑,故答案为:2H++2e-═H 2↑;2Fe2++2H+?电解?.?2Fe3++H 2↑;
(2)①碳酸钠和硫化氢发生的反应为:CO32-+H2S═HS-+HCO3-,碳酸氢钠和强碱NaOH反应得到碳酸钠,
即HCO3-+OH-═CO32-+H 2O,故答案为:CO32-+H2S═HS-+HCO3-;HCO3-+OH-═CO32-+H 2O;
②硫化氢可以被氧气氧化为单质硫,根据硫化氢和氧气的量的关系2H 2S~O 2,消耗氧气的量10%×1800m3×0.5=90m3,氧气站空气含量的20%,所以理论上消耗空气的体积=90m3×5=450m3,故答案为:450;
(3)两种方法中氯化铁和碳酸钠可以循环使用,故答案为:吸收剂可循环使用.
本题解析:
本题难度:一般
2、填空题 在常见的非金属及其化合物中:
(1)晶体硅的导电性介于导体和绝缘体之间,是良好的 材料;硅酸钠水溶液俗称为 ,是制备硅胶和木材防火剂的原料;陶瓷、 、水泥等硅酸盐产品是使用量最大的无机非金属材料。
(2)氯元素是重要的“成盐元素”,将氯气通入NaOH溶液中可以得到漂白液,反应的离子方程式是 ;漂白液有效成分的化学式为 。
(3)水是常见的非金属元素化合物,请按要求写出下列水参加的反应的化学方程式。
①水只作氧化剂:
②NO2气体通入水中:
③水既作氧化剂又作还原剂:
参考答案:(1)半导体 水玻璃 玻璃
(2)Cl2+2OH-=Cl-+ClO-+H2O NaClO
(3)①2Na+2H2O 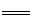 2NaOH+H2↑ 等
2NaOH+H2↑ 等
②3NO2+H2O  2HNO3+NO
2HNO3+NO
③2H2O  2H2↑+O2↑
2H2↑+O2↑
本题解析:(1)晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,硅酸钠水溶液俗
称为水玻璃,陶瓷、玻璃、水泥是使用量最大的无机非金属材料;
(2)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,其中漂白液有效成分是次氯酸钠,化学式为NaClO;
(3)①水只作氧化剂:钠与水的反应、铁与水蒸气的反应、碳与水蒸气的反应等,
②NO2气体通入水中生成硝酸和一氧化氮,化学方程式为3NO2+H2O  2HNO3+NO,
2HNO3+NO,
③水既作氧化剂又作还原剂,水的电解,2H2O  2H2↑+O2↑
2H2↑+O2↑
考点:考查物质的俗称、无机非金属材料、硅的用途的判断,漂白粉的生成,化学方程式的书写
本题难度:一般
3、填空题 (12分)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
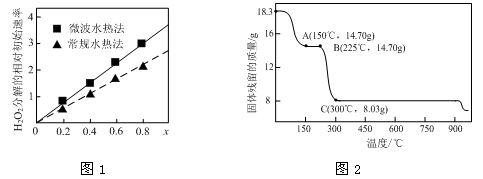
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
参考答案:(1)①+3 ②微波水热 Co2+
(2)① Co3O4(写成CoO·Co2O3亦给分) 3CoC2O4 + 2O2 = Co3O4 +6CO2
②由电子守恒:n(Co3+) =" 2" n(Cl2) =" 0.4" mol(1分)
由电荷守恒:n(Co)总=n(Co2+)溶液=" 0.5" n(Cl-) =" 0.5×(" 2.4mol-0.2mol×2)=" 1" mol
所以固体中的n(Co2+)= 1mol-0.4mol=" 0.6" mol(1分)
n(O)=(0.4mol×3+0.6mol×2)÷2=1.2mol(1分)
故n(Co):n(O)=1mol:1.2mol=5:6(1分)
(除第(1)②小题每空1分,第(2)②小题4分外,其余每空2分,共12分)
本题解析:(1)①该催化剂中Co、Ni均为+2价,O为-2价,所以Fe元素的化合价是[8-(2x+2-2x)]/2=+3;
②反应速率越快,则催化剂的催化活性越高,根据图像可知,x相同时微波水热法初始反应速率大于常规水热法,所以微波水热法制取得到的催化剂活性更高;随x增大,初始速率增大,而x增大,Co2+的比例增大,所以Co2+的催化效果更好;
(2)①由题意知,二水合草酸钴(CoC2O4·2H2O)的起始质量是18.3g,物质的量是0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量是8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16g/mol=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1:0.133125=3:4,所以C点对应固体的化学式是Co3O4;B点对应的物质的质量是14.70g,与 起始的固体质量相比减少18.3-14.7=3.6g,恰好为结晶水的质量,所以B点对应的物质是草酸钴,与O2在225℃~300℃发生反应生成Co3O4和二氧化碳,所以反应的化学方程式是3CoC2O4 + 2O2 = Co3O4 +6CO2;
②设该钴的氧化物中+3价Co的原子个数是x,与盐酸反应得到的黄绿色气体为氯气,物质的量是4.48L/22.4L/mol=0.2mol,则反应中失去电子的物质的量是0.4mol,Co最终都变为+2价,则+3价Co得到电子的物质的量是x=0.4,480 mL 5 mol/L盐酸中氯离子的物质的量是0.48L×5mol/L=2.4mol,被氧化的氯离子的物质的量是0.4mol,所以溶液中还余氯离子的物质的量是2.4-0.4=2.0mol,根据Cl元素守恒,所以CoCl2的物质的量是1.0mol,则钴的氧化物中+2价钴的物质的量是1.0-0.4=0.6mol,根据正负化合价的代数和为0,则钴的氧化物中O元素的物质的量是(0.4mol×3+0.6mol×2)/2=1.2mol,所以该钴氧化物中Co、O的物质的量之比为1.0:1.2=5:6.
考点:考查元素化合价的判断,物质化学式的计算,得失电子守恒规律的应用
本题难度:困难
4、填空题 (10分)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ______________?
(2)在该反应中,得电子的物质是______________ ,被氧化的元素是______________;
(3)在反应中,每转移1 mol电子,消耗(或生成)HCl_______mol;
(4)下列叙述正确的是_____________(填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
d. 在上市反应中,氧化性:SnCl2 ?>As还原性:H3AsO3>H2SnCl6
参考答案:(1)12HCl+3SnCl2+2H3AsO3? 2As+6H2O+3H2SnCl6
(2)H3AsO3? +2价Sn
(3)2?(4) ac
本题解析:略
本题难度:一般
5、选择题 下列电子式书写错误的是?
A? Na+?B?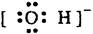 ?C?
?C?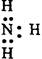 ?D?
?D?
参考答案:C
本题解析:C中,氨气的电子式中,氮原子缺少了两个电子,应该为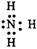 ,所以答案为C。
,所以答案为C。
点评:本题考查了电子式的书写,是对基础知识的考查,该题很容易。
本题难度:简单