微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 32g?Cu与一定量的浓硫酸加热后,恰好完全反应,反应方程式如下:Cu+2H2SO4
CuSO4+SO2↑+2H2O
问:(1)得到SO2气体的体积(标准状况下)是多少?
(2)把所得的CuSO4?配制成250mL?CuSO4溶液,所得溶液中溶质的物质的量浓度.
参考答案:n(Cu)=32g64g/mol=0.5mol,
Cu+2H2SO4?△?.?CuSO4+SO2↑+2H2O
1mol? 1mol? 22.4L
0.5mol? n(CuSO4)?V(SO2)
(1)V(SO2)=0.5mol×22.4L1mol=11.2L
答:得到SO2气体的体积(标准状况下)是11.2L.
(2)n(CuSO4)=0.5mol
c(CuSO4)=0.5mol0.25L=2mol/L.
答:把所得的CuSO4?配制成250mL?CuSO4溶液,所得溶液中溶质的物质的量浓度为2mol/L.
本题解析:
本题难度:一般
2、选择题 下列物质中,属于酸酐的是
A.NO2
B.CO
C.SO2
D.CuO
参考答案:C
本题解析:略
本题难度:一般
3、选择题 下列解释实验现象的反应方程式正确的是
A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO4+H2O
B.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72—+H2O 2CrO42—+2H+
2CrO42—+2H+
C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
D.铝热反应的原理为:Al2O3+2Fe 2Al+Fe2O3
2Al+Fe2O3
参考答案:B
本题解析:A.氧元素元素不守恒;相关化学方程式:SO2+2NaOH=Na2SO3+H2O;C.漏写物质NH3·H2O:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O。 D.铝热反应的原理为:Fe2O3+2Al高温 2Fe+Al2O3。
本题难度:一般
4、简答题 右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:
(1)求该浓盐酸的物质的量浓度.
(2)用上述浓盐酸和二氧化锰加热反应制取氯气,若生成氯气的体积在标准状况下为4.48L时,则被氧化的HCl的质量为多少克?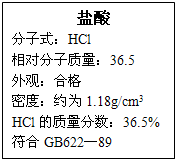
参考答案:(1)盐酸的物质的量浓度为c=1000ρwM=1000×1.18×36.5%36.5mol/L=11.8moL/L,
答:该浓盐酸的物质的量浓度为11.8mol/L;
(2)反应的方程式为MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O,
根据方程式计算:
? MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O
?4×36.5g? 22.4L
? m? 4.48L
m=4×36.5g×4.48L22.4L=29.2g,
根据方程式和化合价的变化情况可知,被氧化的盐酸是参加反应的盐酸的一半,
所以被氧化的HCl的质量为29.2g2=14.6g,
答:被氧化的HCl的质量为14.6g.
本题解析:
本题难度:一般
5、选择题 如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
A.该硫酸试剂可以做干燥剂,干燥任何气体
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200mL4.6mol?L-1的稀硫酸需取该硫酸50.0mL
D.常温下,2.7gAl与足量的稀硫酸反应得到H23.36L
