微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 A、B、W、D、E为原子序数依次增大的五种短周期元素,已知:五种元素的原子质子数之和为39,且B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期数与主族序数相等.
(1)E元素在周期表中的位置为______周期______族.
(2)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱.请写出:A2W2的电子式______;其第一步电离的电离方程式______.工业上常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式______.
(3)由A、B两种元素形成的共价化合物甲,摩尔质量为30g/mol,在25℃,101kPa下,5克的甲气体完全燃烧,生成二氧化碳和液态水时放热?a?kJ,则可表示甲的燃烧热的热化学方程式为:______.
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使其转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡印刷电路板达到上述目的,又保护了环境,试写出反应的离子方程式______.
参考答案:A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,则:
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族.
故答案为:三,ⅢA.
(2)A2W2为H2O2,氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对,电子式为
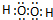
,H2O2是二元弱酸,以第一步电离为主,则电离方程式为H2O2

HO2-+H+,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2.
故答案为:
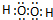
;H2O2

HO2-+H+;BaO2+H2SO4=BaSO4↓+H2O2.
(3)由A、B两种元素形成的共价化合物甲,摩尔质量为30g/mol,则甲为C2H6,5克的乙烷气体的物质的量为5g30g/mol=16mol,1mol乙烷完全燃烧放出的热量为6akJ,在25℃,101kPa下,甲的燃烧热的热化学方程式为:C2H6?(g)+722O2(g)=2CO2(g)+3H2O(l);△H=-6a?kJ?mol-1.
故答案为:C2H6?(g)+72O2(g)=2CO2(g)+3H2O(l);△H=-6a?kJ?mol-1.
完全燃烧,生成二氧化碳和液态水时放热?a?kJ,
(4)Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O.
故答案为:Cu+2H++H2O2=Cu2++2H2O.
本题解析:
本题难度:一般
2、填空题 麻醉剂是手术台上不可缺少的药品,它可使患者在接受治疗中免受疼痛的折磨.氯仿、氙气、乙醚等是临床上常见的麻醉剂,请回答下列问题:
(1)麻醉剂氯仿(CHCl3)属于下列哪类物质(填序号)______;氯仿常因保存不善而被氧化,产生剧毒物光气(COCl2),其反应方程式为:2CHCl3+O2→2HCl+2COCl2.为防止发生医疗事故,使用前可用于检验氯仿是否变质的试剂是(填序号)______.①烃?②无机物?③氯代烃?④淀粉碘化钾溶液?⑤NaOH溶液⑥酚酞溶液?⑦硝酸酸化的硝酸银溶液
(2)人们曾用体积分数为80%的氙气和20%的氧气组成的混合气体,作为无副作用的麻醉剂.疝、氧在元素周期表中的位置分别为______、______,其中疝的原子序数是______.已知氙在一定条件下可与氟气生成氟化物:若取1mol氙气和3.5mol氟气于一密闭容器内充分反应后,余下了1.5mol氟气,同时有白色固体生成,则白色固体的化学式为______.
参考答案:(1)烃中的氢原子被卤素原子代替的产物成为卤代烃,CHCl3中的氢原子被Cl原子代替,称为氯代烃,根据被氧化发生的反应是2CHCl3+O2→2HCl+2COCl2,产物中有HCl气体产生,氯化氢能和酸化的硝酸银溶液反应生成氯化银白色沉淀,而氯仿和酸化的硝酸银溶液不反应,所以可用酸化的硝酸银溶液检验是否被氧化,故答案为:③;⑦;
(2)疝疝的原子序数是54,在元素周期表中的位置为第5周期零族,氧在元素周期表中的位置为第2周期ⅥA族,3.5moL氟气反应剩余1.5mol氟气,反应了2mol氟气,1molXe与2moL氟气反应生成物中Xe原子与氟原子物质的量之比为1:(2×2)=1:4,所以生成的白色固体的化学式为XeF4,故答案为:第5周期零族;第2周期ⅥA族;54;XeF4.
本题解析:
本题难度:一般
3、选择题 关于主族元素的叙述,不正确的是
[? ]
A.主族序数等于元素原子的最外层电子数
B.元素的最高正价一般等于原子最外层电子数
C.最低负价的绝对值等于原子最外层达稳定结构时所需电子数
D.都既有正价,又有负价
参考答案:D
本题解析:
本题难度:简单
4、选择题 某周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数为
[? ]
A.只能是x+l
B.可能是x+8或x+18
C.可能是x+2
D.可能是x+l或x+11或x+25
参考答案:D
本题解析:
本题难度:简单
5、选择题 按C、N、O、F的顺序,下列递变规律正确的是( )
A.原子半径逐渐增大
B.元素原子得电子能力逐渐减弱
C.气态氢化物稳定性逐渐增强
D.最高化合价逐渐增高
参考答案:C、N、O、F在周期表相同周期,从左到右原子序数逐渐增大,则
A.同周期元素从左到右原子半径逐渐减小,故A错误;
B.同周期元素从左到右元素的非金属性逐渐增强,得电子能力逐渐增强,故B错误;
C.同周期元素从左到右元素的非金属性逐渐增强,对应的气态氢化物稳定性逐渐增强,故C正确;
D.F的最高化合价为0价,无正价,故D错误.
故选C.
本题解析:
本题难度:一般