| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《物质的分离、提纯》试题强化练习(2017年最新版)(六)
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处: ①?,②?。 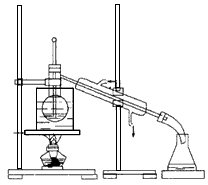 (5)进行上述蒸馏操作时,使用水浴加热的原因是?,最后晶态碘在??里聚集。 参考答案: 本题解析:本题是一道综合实验考查题,考查的是海带中碘单质的提取,先要从海带中灼烧成灰,再溶于水,让碘离子进入到溶液中,然后用强氧化剂把碘离子氧化成而碘单质,再用四氯化碳把碘单质进行萃取,最后把碘和萃取液进行分离,分离碘和四氯化碳时,一定要用蒸馏的方法,因为四氯化碳的沸点低,因此碘会出现在蒸馏烧瓶中。 本题难度:一般 4、选择题 下列实验操作中正确的是( ) 参考答案:D 本题解析: 本题难度:一般 5、选择题 设NA表示阿伏加德罗常数,下列叙述正确的是 参考答案:AC 本题解析:分析:A、根据电子守恒,71g氯气物质的量是1mol,反应得到2mol电子; 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《化学平衡》.. | |