微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
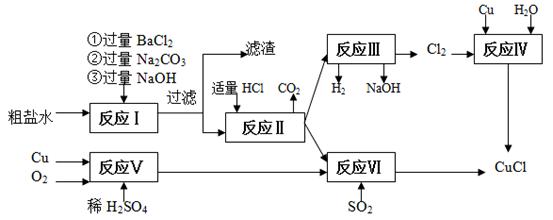
(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是??;
滤渣的主要成分:?。
(2)反应Ⅱ完成后溶液中主要溶质是?。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是?。
②写出反应VI的离子方程式?。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是?。
参考答案:(1)除去Ca2+和过量的Ba2+? BaSO4、CaCO3、Mg(OH)2、BaCO3?(2)NaCl?
(3)防止生成CuCl2? 2Cu2++2Cl-+SO2+2H2O = 2CuCl↓+4H++SO42-
(4)加快乙醇和水的蒸发,防止CuCl被空气氧化
本题解析:(1)分析流程图知,反应Ⅰ为粗盐的提纯,为保证杂质离子除尽所加试剂要过量,加过量氯化钡溶液除硫酸根,加过量Na2CO3溶液可以粗盐溶液中的除去Ca2+和除去硫酸根离子所加的过量的Ba2+,加过量氢氧化钠溶液除镁离子;答案为:除去Ca2+和过量的Ba2+;(2)分析流程图知,反应Ⅱ完成后溶液中主要溶质是氯化钠;(3)①反应Ⅳ加入的Cu必须过量,金属铜可以和铜离子在溶液中生成亚铜离子,这样可以防止生成CuCl2;②二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀,反应的离子方程式为2Cu2++2Cl-+SO2+2H2O = 2CuCl↓+4H++SO42-;(4)根据题给信息知,氯化亚铜(CuCl)在空气中迅速被氧化成绿色,CuCl沉淀在真空干燥机内于70℃干燥2小时的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化。
本题难度:一般
2、选择题 用下列各组仪器或装置,不能达到实验目的的是
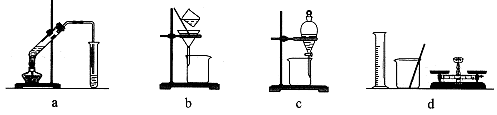
A.a组:制备少量乙酸乙酯
B.b组:除去粗盐水中的泥沙
C.c组:用CCl4提取碘水中的碘
D.d组:配制100 mL 1.00 mol/L NaCl溶液
参考答案:D
本题解析:A、乙酸、乙醇和浓硫酸在试管中共热制取乙酸乙酯,用饱和碳酸钠溶液吸收,正确;B、除去液体中的不溶固体用过滤的方法,正确;C、碘易溶于四氯化碳,四氯化碳与水互不相溶,溶液分层,用分液的方法将其分离,正确;D、配制溶液除所给仪器外,还需要100mL的容量瓶,错误,答案选D。
本题难度:简单
3、选择题 在实验室中从苯酚中分离出苯,可选用下列装置中的(?)
 A.?B.? C.?D.
A.?B.? C.?D.
参考答案:AB
本题解析:苯酚和苯互溶,但二者的沸点相差较大,所以可以通过蒸馏的方法实现分离。另外苯酚能和氢氧化钠溶液反应,生成可溶性的苯酚钠,所以也可以通过分液的方法实现分离,B正确;C是渗析,适用于胶体的提纯,D是蒸发,不适用于液体和液体的分离,答案选AB。
点评:分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:①分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解),溶解,过滤(洗涤沉淀),蒸发,结晶(重结晶);②分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏;③分离提纯物是胶体:盐析或渗析;④分离提纯物是气体:洗气。
本题难度:简单
4、填空题 某粗盐主要成分为氯化钠,杂质为不溶性泥沙和可溶性的MgCl2、CaCl2和Na2SO4.某校化学兴趣小组欲探究食盐的精制过程,以该粗盐为原料,设计方案流程如下:
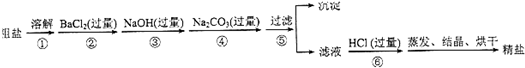
试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是______、______.
(2)第②步操作的目的是除去粗盐中的______?(填化学式,下同),第⑥步操作的目的是除去滤液中的______、______.
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______、______(填化学式)
(4)在第⑨步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是______.写出第⑥步涉及的两个化学反应的离子方程式:______、______.
参考答案:(1)在粗盐提纯时,用玻璃棒溶解,玻璃棒的作用是加速粗盐的溶解,过滤是将固体和液体进行分离的一种操作,玻璃棒在其中的作用是引流,故答案为:加速粗盐的溶解;引流;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,步骤②是为了除去硫酸钠,第⑥步操作加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,
故答案为:Na2SO4;HCl;Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3以及BaCO3,故答案为:CaCO3;BaCO3;
(4)加入氢氧化钠,可以除去溶液中的氯化镁,发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,选择的除杂试剂不能用KOH代替NaOH,否则会引入钾离子,第⑥步加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,实质是:H++OH-=H2O,CO32-+2H+=H2O+CO2↑,
故答案为:会引入新的杂质KCl;H++OH-=H2O;CO32-+2H+=H2O+CO2↑.
本题解析:
本题难度:一般
5、填空题 人们可根据物质的性质,采用适当的方式将混合物中的各物质分离。
(1)不溶性固体与水的混合物,如泥沙与水,可通过?方法分离。
(2)可溶性固体与水的混合物,如食盐与水,可通过?方法分离。
(3)两种可溶性固体,若它们的溶解度随温度变化不同,如氯化钠和硝酸钾,可通过
?方法分离。
(4)两种互相溶解但沸点不同的液体,如乙醇与水,可通过?方法分离。
(5)两种互不相溶的液体,如汽油与水,可通过?方法分离。
(6)若混合物中各成分被某种固体吸附的难易不同,如墨水中的染料,可通过?方法分离。
参考答案:(1)过滤(2)蒸发结晶(3)降温结晶(4)蒸馏(5)分液?(6)层析
本题解析:略
本题难度:简单