微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应
 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
参考答案:(每空2分,共14分)
(1)-247KJ·mol-1 K12·K2·K3
(2)a·c
(3) = K=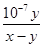 mol·L-1
mol·L-1
(4)碱性 O2+2H2O+4e-=4OH-
本题解析:(1)根据盖斯定律得3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
(2)a、容器体积固定,3C O(g) +3H2(g) CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
(3)根据电荷守恒定律,盐酸与氨水混合后的溶液显中性,则c(H+)=c(OH-),c(Cl-)+ c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+);在25℃下,中性溶液中c(H+)= c(OH-)=1×10-7mol/L,若盐酸与氨水的浓度相等,则等体积混合后生成氯化铵溶液显酸性,而实际溶液显中性,说明氨水的浓度大于盐酸的浓度,氨水过量,设二者的体积均为1L,与盐酸反应完剩余氨水的物质的量(x-y)mol,一水合氨的浓度为(x-y)/2mol/L,c(NH4+)=c(Cl-)=y/2mol/L,则氨水的电离平衡常数K= c(OH-)c(NH4+)/ c(NH3·H2O)= 1×10-7mol/L×y/2mol/L/(x-y)/2mol/L=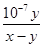 mol·L-1,
mol·L-1,
(4)根据电池反应式为:4NH3+3O2 =2N2+6H2O,判断氨气发生氧化反应,氧气发生还原反应,氨气失电子成为氮气和氢离子,所以电解质溶液应显碱性,产物中才能生成水;因为电解质溶液为碱性,所以正极是氧气的还原反应,氧气得电子与水结合生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-
考点:考查盖斯定律的应用 ,化学平衡状态的判断,化学平衡常数的计算,原电池反应原理的应用
本题难度:困难
2、选择题 X、Y两种元素的原子,当它们分别得到1个电子,形成与稀有气体原子电子层结构相同的阴离子时,X放出的能量比Y多,可推断
A.X的原子序数大于Y
B.X元素的非金属性比Y元素强
C.X单质的颜色比Y单质的深
D.X的氢化物不如Y的氢化物稳定
参考答案:B
本题解析:得到一个电子放出的能量X比Y多,说明X原子比Y容易夺得电子,可得出X元素的非金属性比Y元素强,X的氢化物比Y的氢化物稳定,B项正确,D项错误.A、C两选项中的事实与元素的非金属性强弱间没有必然的联系.
本题难度:困难
3、选择题 火山爆发产生的气体中含有1%的羰基硫(化学式为COS,C===O就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )
A.羰基硫中O为-2价,C、S都是+1价
B.羰基硫分子中共含有3个原子核、16个电子
C.羰基硫分子结构中只含有共价键
D.羰基硫的电子式为?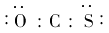
参考答案:C
本题解析:在分子中碳原子形成2个双键,电子式为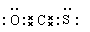 ,D不正确。其中双键都是偏离碳原子的,所以碳的化合价是+4价,氧和硫都是-2价,A不正确。羰基硫分子中共含有3个原子核、电子是6+8+16=30,B不正确。C、O、S都是非金属,形成的化学键是极性键,C正确。答案选C。
,D不正确。其中双键都是偏离碳原子的,所以碳的化合价是+4价,氧和硫都是-2价,A不正确。羰基硫分子中共含有3个原子核、电子是6+8+16=30,B不正确。C、O、S都是非金属,形成的化学键是极性键,C正确。答案选C。
本题难度:一般
4、选择题 已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量 ②1mol Cl2分子中化学键断裂时需要吸收
243kJ的能量 ③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量下列叙述正确的是
[? ]
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
参考答案:C
本题解析:
本题难度:一般
5、选择题 已知:①101 kPa时,C(s)+1/2O2(g)===CO(g) ΔH1=-110.5 kJ/mol;
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ/mol
下列结论正确的是
A.若碳的燃烧热用ΔH3来表示,则ΔH3<ΔH1
B.若碳的燃烧热用ΔH3来表示,则ΔH3>ΔH1
C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量