微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积时m倍和n倍后,两溶液的pH值仍然相同,则m和n的关系是( )。
A.m<n
B.m>n
C.m=n
D.无法确定
参考答案:A
本题解析:盐酸为强酸,醋酸为弱酸,若将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积的相同倍数后,醋酸溶液的PH更小,若要使稀释后溶液的PH相同,则醋酸加水更多,即.m<n
本题难度:一般
2、选择题 某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是?
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa? b.C6H5ONa? c.NaHCO3?d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥pH=4、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A.①②④
B.①③⑤
C.③⑤⑥
D.②④⑥
参考答案:C
本题解析:① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低,但是氢氧根离子浓度会升高,错误;② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等,这个说法也是错误的,原因是两种溶液中氯化铵的浓度不一样大,水解程度不一样。③ pH相等的四种溶液:a.CH3COONa? b.C6H5ONa? c.NaHCO3?d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a,正确。因为酸性强弱顺序为:醋酸、碳酸、苯酚,所以相应的钠盐的碱性强弱就为苯酚钠、碳酸氢钠、醋酸钠,四种溶液的溶质的物质的量浓度由小到大的顺序为:d < b < c < a;④ pH=8.3的NaHCO3溶液中,碳酸氢根离子存在水解和电离子两种趋势,又由于溶液显碱性,因此水解程度大于电离程度,所以有:c(Na+) > c(HCO3-)> c(H2CO3) > c(CO32-),所以错误;⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+),正确;⑥pH=4、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中,表明溶液显酸性,也就是说醋酸的电离程度比醋酸根离子的水解程度大。所以有: c(CH3COOH)<c(Na+),再根椐电荷守恒:c(CH3COO-)+c(OH-) = c(Na+)+c(H+),于是就有以下关系式:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)。因此选C。
本题难度:一般
3、填空题 (10分)饱和亚硫酸溶液的pKa(电离平衡常数的负对数,即pKa=-lgKa)数据如下:
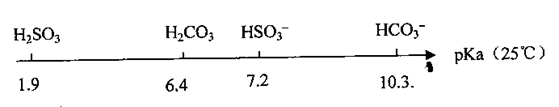
(1)比较H2SO3的Ka1和HSO3-的Ka2,Ka1?Ka2(填‘‘>”、“<’’或“=”,下同)
(2)0.01 m ol.L-1NaHSO3溶液的pH=bl,0.01 tml·L-1NaHCO3溶液的pH=b2,
b1?b2
(3)向10 mL 0.01 mol·L-1的H2SO3溶液中,滴加0.0l mol·L-1KOH溶液V(mL),
①当V="10" mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)??c(OH-)
②当V="a" mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-);当V="b" mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3);则a ?b。
(4)已知25℃时,Ksp(BaSO4)=1×10-10,将0.1 gBaSO4沉淀,分别用100mL蒸馏水和100mL 0.01mo1.L-1H2SO4溶液洗涤,两种洗涤方法中BaSO4沉淀的损耗量之比为?.
参考答案:(10分)
(1)>(2分)
(2)<(2分)
(3)①>,(2分)? ②>(2分)
(4)1000(2分)
本题解析:
专题:电离平衡与溶液的pH专题.
分析:(1)根据pKa为电离平衡常数的负对数,即pKa=-lgKa,则pKa越小,电离平衡常数Ka越大;
(2)根据pKa越小,电离平衡常数Ka越大,则对应酸的酸性就强,利用酸越弱则强碱弱酸盐的水解程度越大来分析;
(3)①V=10mL,溶液中的溶质为NaHSO3,由c(HSO3-)>c(SO32-)>c(H2SO3),可知HSO3-的电离大于其水解来分析;
②V="a" mL时由c(K+)=2c(SO32-)+c(HSO3-),则c(H+)=c(OH-);V="b" mL时,c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),即溶液中的溶质为KHSO3,溶液显酸性;
(4)利用离子对溶解平衡的影响及Ksp(BaSO4)来计算溶解的硫酸钡的质量,然后确定两种洗涤方法中BaSO4沉淀的损耗量之比.
解答:解:(1)由pKa数据可知,1.9<7.2,由pKa=-lgKa,则pKa越小,电离平衡常数Ka越大,则H2SO3的Ka1>HSO3-的Ka2,
故答案为:>;
(2)由pKa数据可知,亚硫酸的pKa小于碳酸,则酸性比碳酸的强,相同浓度的NaHSO3溶液比NaHCO3溶液中酸根离子的水解程度弱,则NaHSO3溶液的pH小,即bl<b2,故答案为:<;
(3)①V=10mL,溶液中的溶质为NaHSO3,由c(HSO3-)>c(SO32-)>c(H2SO3),可知HSO3-的电离大于其水解,电离生成氢离子,水解生成氢氧根离子,即c(H+)>c(OH-),故答案为:>;
②V="b" mL时,c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),即溶液中的溶质为KHSO3,溶液显酸性;当V="a" mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-),由电荷守恒可知c(H+)=c(OH-),即溶液显中性,则向10mL0.01mol?L-1的H2SO3溶液中,滴加0.0l mol?L-1KOH溶液,由酸性变为中性时碱的体积在变大,即a>b,故答案为:>;
(4)用100mL蒸馏水洗涤沉淀时,溶解的BaSO4的物质的量为0.1L×c(Ba2+)=0.1L×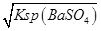 =0.1L×
=0.1L× mol/L=10-6mol,
mol/L=10-6mol,
用100mL 0.01mo1.L-1H2SO4溶液洗涤时,硫酸根离子抑制了沉淀的溶解,则溶解的BaSO4的物质的量为0.1L×c(Ba2+)=0.1L×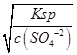 =0.1L×
=0.1L×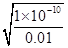 mol/L=10-9mol,
mol/L=10-9mol,
由同种物质的质量之比等于物质的量之比,则两种洗涤方法中BaSO4沉淀的损耗量之比为 =1000,故答案为:1000.
=1000,故答案为:1000.
点评:本题考查溶液中的电离及离子的浓度关系,考查知识点为高考的热点,学生应学会利用信息中的数据来分析是解答本题的关键,然后注重结合所学知识来解答即可.
本题难度:一般
4、填空题 醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:
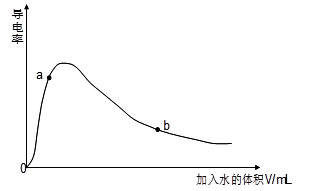
①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1="-57.3" kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
参考答案:(1)①醋酸为共价化合物,只在水溶液中才能电离(2分);
②<;>;=(3分,各1分);
③1.3×10-3 (1分); 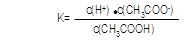 ="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
(2)CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol (3分)
(3)c(CH3COOH)+c(CH3COO-)=2c(Na+)或c(CH3COOH)+c(CH3COO-)=0.1mol/L;
c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (4分;各2分)
本题解析:(1)①醋酸是共价化合物,液态醋酸中不存在自由移动的离子;
②对于弱电解质溶液而言,溶液越稀越易电离,所以b点醋酸的电离程度大于a点,H+的物质的量b点大于a点;尽管氢离子物质的量在增大,但增大的幅度不如溶液体积增大的多,所以离子浓度减小,因此b点醋酸根离子浓度小于a点;无论a还是b点,醋酸的物质的量不变,所以需要氢氧化钠的物质的量相等;
③醋酸电离产生等浓度的CH3COO-和H+,所以此时c(CH3COO-)约为1.3×10-3 mol/L;b点的平衡常数K= c(CH3COO-)·c(H+)/ c(CH3COOH)=( 1.3×10-3 mol/L)2/0.10mol/L=1.7×10-5 mol/L;
(2)将已知2个热化学方程式相加得:CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol 即为稀醋酸与稀烧碱溶液反应的热化学方程式;
(3)醋酸电离使溶液呈酸性,醋酸钠水解使溶液呈碱性,浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,说明醋酸的电离程度大于醋酸钠的水解程度。则混合液中的物料守恒有:醋酸和醋酸根离子的浓度和是钠离子浓度的2倍,c(CH3COOH)+c(CH3COO-)=2c(Na+);或者混合液中醋酸和醋酸根离子的浓度和是0.10mol/L,c(CH3COOH)+c(CH3COO-)=0.1mol/L;根据以上分析,醋酸的电离程度大于醋酸钠的水解程度,所以混合液中离子浓度最大的是醋酸根离子,其次是钠离子,再次是氢离子,最小是氢氧根离子,c(CH3COO-)>c(Na+)c(H+)>c(OH-)。
考点:考查弱电解质溶液的离子浓度、电离平衡的判断,热化学方程式的书写,混合液的物料守恒及离子浓度大小的比较
本题难度:困难
5、选择题 将4.0?g氢氧化钠固体分别加入下列100?mL溶液中,溶液的导电能力变化不大的是
[? ]
?①自来水 ②3.65?g?HCl ③6.0?g醋酸 ④5.35?g?NH4Cl
A.①② ?
B.②③
C.③④?
D.②④
参考答案:D
本题解析:
本题难度:一般