微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铜锌原电池如图工作时,下列叙述正确的是

A 正极反应为:Zn—2e-=Zn2+?
B电池总反应为:Zn+2H+=Zn2+ + H2↑
C 盐桥主要作用是形成回路、中和两极电荷
D 盐桥中的Cl—移向CuSO4溶液?
参考答案:C
本题解析:略
本题难度:一般
2、填空题 (1)在CH4、H2S、NH4+、H2O、OH—、HCl、Na、Mg2+八种粒子中,选择符合下列要求的粒子填空:
①上述粒子中与K+质子数不同,电子数相同的有 ;
②上述粒子中与NH3质子数相同,电子数也相同的有 ;
③上述粒子中电子数大于质子数的有 。
(2)用锌片、铜片和稀硫酸组成的原电池,该电池的负极材料是 ,正极的电极反应式为 ,电池工作时电子流向 (填“正极”或“负极”)。
(3)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为 ;
②A的平均反应速率为 ;
③5min时B的转化率为 。
参考答案:(13分)(1) ①H2S、HCl (1分) ②CH4、H2O (1分) ③OH— (1分)
(2) 锌片 (1分) 2H++2e—=H2↑ (2分) 正极 (1分)
(3)① 1 (2分) ②0.3mol?L-1?min -1(2分) ③50% (2分)
本题解析:(1)①K+质子数于电子数分别是19和13,则与K+质子数不同,电子数相同的有H2S、HCl。
②氨气含有10个质子和10个电子,则与NH3质子数相同,电子数也相同的有CH4、H2O.
③电子数大于质子数,说明带负电荷,则是OH-。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,据此可知,该电池的负极材料是锌片,铜是正极,溶液中的氢离子得到电子,则正极的电极反应式为2H++2e—=H2↑,电池工作时电子流向正极。
(3)①经5min后反应达到平衡状态,容器内的压强变小,这说明该反应是体积减小的可逆反应,即3+1>x+2,所以x只能是1;
②D的平均反应速率为0.2mol/(L?min),则根据反应速率之比是相应的化学计量数之比可知,A的平均反应速率是0.3mol/(L?min)。
③生成D的物质的量是0.2mol/(L?min)×5min×2L=2mol,所以消耗B的物质的量是1mol,则B的转化率是50%。
考点:考查质子数和电子数的计算、原电池的判断以及反应速率的有关计算等
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练,旨在培养学生灵活运用基础知识解决实际问题的能力,难度不大,有利于培养学生的规范答题能力,提高学生的应试能力。
本题难度:一般
3、填空题 (共8分)燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)已知燃料电池的总反应式为CH4 + 2O2 + 2KOH ="=" K2CO3?+ 3H2O,电池中有一极的电极反应为CH4 + 10 OH- - 8e- ==? CO2-3 + 7H2O,这个电极是燃料电池的?(填“正极”或“负极”),另一个电极上的电极反应式为:?
(2)随着电池不断放电,电解质溶液的碱性?(填“增大”、“减小”或“不变”)
(3)通常情况下,甲烷燃料电池的能量利用率?(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
参考答案:(1)负极;? 2O2+4H2O+8e-==8OH-?(2)减小?(3)大于
本题解析:(1)原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应。所以甲烷在负极通入,氧气在正极通入。由于溶液中电解质是氢氧化钾,所以正极反应式是
2O2+4H2O+8e-==8OH-。
(2)根据总的反应式可知,在反应过程中是消耗氢氧化钾的,所以溶液的碱性是降低的。
(3)燃料电池的硫利用率要大于甲烷直接燃烧的能量利用率。
本题难度:一般
4、选择题 人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为 Zn+2OH--2e-=ZnO+H2↑,
Ag2O+H2O+2e-==2Ag+2OH-。据此判断Ag2O是
[? ]
A.负极,被氧化
B.正极,被还原
C.负极,被还原
D.正极,被氧化
参考答案:B
本题解析:
本题难度:一般
5、填空题 Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式
| HF
| H2CO3
| HClO
|
电离平衡常数
(K)
| 7.2×10-4
| K1=4.4×10-7
K2=4.7×10-11
| 3.0×10-8
|
?
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。
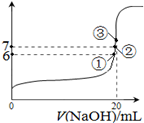
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l)? ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l)? ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) ?△H=–97.3kJ·mol—1
SO2Cl2(l) ?△H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度?b.移走SO2Cl2
c.增加反应物浓度?d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2)? b.容器中气体压强不随时间而变化?
c.c(Cl 2) : c(SO2)=1:1? d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
参考答案:Ⅰ. (1)①④②③(或①>④>②>③,用物质名称表示也对)(2分) (2)BC(2分)
(3)HF(aq) 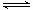 H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(2分,不写可逆号扣1分)
H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(2分,不写可逆号扣1分)
(4)1(2分)
Ⅱ.(1)K= (2分) 2)d(2分)(3)bd(2分)
(2分) 2)d(2分)(3)bd(2分)
(4)7.616g<m(SO2)<15.232g(2分)
本题解析:Ⅰ.(1)根据越弱越水解,电离常数越小,盐水解时碱性越强,碳酸的二级电离常数最小,所以①碱性最强,其次是④,再次是②,最小是③;(2)A、HF溶液中对水的电离起抑制作用,NaF溶液中对水的电离起促进作用,因此由水电离出的c(H+)不相等,错误;B、①点时pH=6,根据电荷守恒C(Na+)+C(H+)=C(F-)+C(OH-),c(F-)-c(Na+)= C(H+)- C(OH-)=10-6-10-8=9.9×10-7mol/L,正确;C、②点时,pH=7,溶液呈中性,C(H+)=C(OH-),因此溶液中的c(F-)=c(Na+),正确;D、③点时V=20mL,恰好完全反应得到NaF溶液,c(F-)<c(Na+)=0.05mol·L—1,错误,选择BC;(3)根据盖斯定律,①-②可得HF(aq) 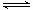 H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(4)H—O—F中F非金属性强,共用电子对偏向它,带负电荷-1,H带正电荷+1,O显0价,HFO+H2O=HF+H2O2,生成1molHF转移1摩尔电子。Ⅱ.(2)该反应是放热反应,要使K增大,只能降低温度,降温反应速率降低,所以选d;(3)a、υ(Cl 2)=υ(SO2)在任何条件下都相等,错误;b、方程左右两边气体分子系数差不等0,所以压强不再改变说明气体物质的量不再变化,达到平衡,正确;c、二者浓度1:1,不能说明它的浓度不再发生变化,错误;d、氯气有颜色,颜色不变,说明浓度不再发生变化,说明达到平衡,正确。(4)平衡体系中,再加入16.20g SO2Cl2,浓度变为原来的2倍,等于增大压强,平衡正向移动,但是不能抵消改变,所以比原来的大,但比2倍的少,7.616g<m(SO2)<15.232g
H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(4)H—O—F中F非金属性强,共用电子对偏向它,带负电荷-1,H带正电荷+1,O显0价,HFO+H2O=HF+H2O2,生成1molHF转移1摩尔电子。Ⅱ.(2)该反应是放热反应,要使K增大,只能降低温度,降温反应速率降低,所以选d;(3)a、υ(Cl 2)=υ(SO2)在任何条件下都相等,错误;b、方程左右两边气体分子系数差不等0,所以压强不再改变说明气体物质的量不再变化,达到平衡,正确;c、二者浓度1:1,不能说明它的浓度不再发生变化,错误;d、氯气有颜色,颜色不变,说明浓度不再发生变化,说明达到平衡,正确。(4)平衡体系中,再加入16.20g SO2Cl2,浓度变为原来的2倍,等于增大压强,平衡正向移动,但是不能抵消改变,所以比原来的大,但比2倍的少,7.616g<m(SO2)<15.232g
本题难度:困难