微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)为体现绿色世博、低碳世博、科技世博,上海世博会已经开始使用中国自己生产的燃料电池汽车,该车以氢气和空气中的氧气为燃料,KOH为电解质溶液,真正实现了“零排放”。该电池的负极反应式为 ,从能量角度分析氢气用作燃料电池与直接燃烧相比主要优点是 。
参考答案:(4分) H2-2e-+2OH-=2H2O 燃料电池的能量转换效率高
本题解析:略
本题难度:简单
2、选择题 下列关于实验现象的描述不正确的是
[? ]
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铁片插入硫酸铜溶液中,铁片表面附着一层紫红色的物质
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:C
本题解析:
本题难度:一般
3、填空题 二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料[ 已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1) △H=-1455kJ/mol ]。同时它也可以作为制冷剂而替代氟氯代烃。工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚; 2CH3OH  CH3OCH3+H2O
CH3OCH3+H2O
②合成气CO与H2直接合成二甲醚: 3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=-247kJ/mol
CH3OCH3(g)+CO2(g) △H=-247kJ/mol
③天然气与水蒸气反应制备二甲醚。以CH4和H2O为原料制备二甲醚和甲醇工业流程如下:

(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式(结果保留一位小数)
(2)在反应室2中,一定条件下发生反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
A.低温高压 B.加催化剂 C.增加CO浓度 D.分离出二甲醚
(3)在反应室3中,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)  CH3OH(g)+H2O (g) △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 (填序号)
CH3OH(g)+H2O (g) △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 (填序号)

A.P3>P2 T3>T2 B.P2>P4 T4>T2
C.P1>P3 T1>T3 D.P1>P4 T2>T3
(4)反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0写出平衡常数的表达式:
CO(g)+3H2(g) △H>0写出平衡常数的表达式:
如果温度降低,该反应的平衡常数 (填“不变”、“变大”、“变小”)
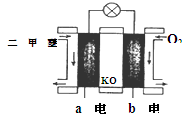
(5)如图为绿色电源“二甲醚燃料电池”的工作原理示意图则a电极的反应式为:________________

(6)下列判断中正确的是_______
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯b中发生反应为2Zn-4eˉ =2Zn2+
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯a中发生反应O2 + 4H++ 4eˉ = 2H2O,溶液pH降低
参考答案:(1)CO(g)+H2(g)+O2(g) CO2(g)+H2O(l) △H=—567.3kJ/mol
CO2(g)+H2O(l) △H=—567.3kJ/mol
(2)AD (3)C D (4)k=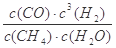 ,变小
,变小
(5)CH3OCH3-12e-+16OH-=2CO32-+11 H2O(6)B
本题解析:(1)将CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1) △H=-1455kJ/mol 和3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g) △H=-247kJ/mol相加,整理可得:CO(g)+H2(g)+O2(g)
CH3OCH3(g)+CO2(g) △H=-247kJ/mol相加,整理可得:CO(g)+H2(g)+O2(g) CO2(g)+H2O(l) △H=—567.3kJ/mol。(2)由于反应3H2(g)+3CO(g)
CO2(g)+H2O(l) △H=—567.3kJ/mol。(2)由于反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=-247kJ/mol的正反应是个气体体积减小的放热反应,所以达到平衡后,要提高CO的转化率,即是平衡正向移动,应该低温高压或分离出二甲醚。加入加催化剂只能缩短达到平衡所需要的时间,但平衡不发生移动。若 增加CO浓度,平衡正向移动,转化量增加,但加入量远远大于平衡转化消耗量,所以CO的转化率反而降低。选项为AD。(3)反应3H2(g)+CO2(g)
CH3OCH3(g)+CO2(g) △H=-247kJ/mol的正反应是个气体体积减小的放热反应,所以达到平衡后,要提高CO的转化率,即是平衡正向移动,应该低温高压或分离出二甲醚。加入加催化剂只能缩短达到平衡所需要的时间,但平衡不发生移动。若 增加CO浓度,平衡正向移动,转化量增加,但加入量远远大于平衡转化消耗量,所以CO的转化率反而降低。选项为AD。(3)反应3H2(g)+CO2(g)  CH3OH(g)+H2O (g) △H<0达到平衡后,若增大压强或降低温度,平衡正向移动,CH3OH的含量增加;若降低压强或升高温度,平衡逆向移动,CH3OH的含量减少。则A.P2>P3,T2>T3.错误。B.P2>P4 T2>T4.错误。C.P1>P3 ,, T1>T3正确。D.P1>P4,T2>T3。正确。(4)反CH4(g)+H2O(g)
CH3OH(g)+H2O (g) △H<0达到平衡后,若增大压强或降低温度,平衡正向移动,CH3OH的含量增加;若降低压强或升高温度,平衡逆向移动,CH3OH的含量减少。则A.P2>P3,T2>T3.错误。B.P2>P4 T2>T4.错误。C.P1>P3 ,, T1>T3正确。D.P1>P4,T2>T3。正确。(4)反CH4(g)+H2O(g) CO(g)+3H2(g) △H>0的化学平衡常数的表达式为k=
CO(g)+3H2(g) △H>0的化学平衡常数的表达式为k=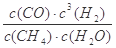 如果温度降低,根据平衡移动原理。化学平衡向放热反应方向(即向逆反应方向)移动,所以该反应的平衡常数减小。(5)在燃料电池“二甲醚燃料电池”中,通入燃料的电极a电极为负极,电极的反应式为CH3OCH3-12e-+16OH-=2CO32-+11 H2O。(6)A.由于活动性Zn>Fe,所以是Zn失去电子,作负极。Fe作正极。因为Fe未发生氧化反应,所以向烧杯a中加入少量K3[Fe(CN)6]溶液,不会有蓝色沉淀生成。A错误,B正确。C. 电子从Zn极流出,流入Fe极,在溶液中阳离子从负极向正极移动,阴离子从正极相负极移动,从而形成闭合回路。错误.D.NaCl溶液呈中性,所以在烧杯a中发生反应O2 + 2H2O + 4eˉ =4OH-,溶液pH升高。错误。
如果温度降低,根据平衡移动原理。化学平衡向放热反应方向(即向逆反应方向)移动,所以该反应的平衡常数减小。(5)在燃料电池“二甲醚燃料电池”中,通入燃料的电极a电极为负极,电极的反应式为CH3OCH3-12e-+16OH-=2CO32-+11 H2O。(6)A.由于活动性Zn>Fe,所以是Zn失去电子,作负极。Fe作正极。因为Fe未发生氧化反应,所以向烧杯a中加入少量K3[Fe(CN)6]溶液,不会有蓝色沉淀生成。A错误,B正确。C. 电子从Zn极流出,流入Fe极,在溶液中阳离子从负极向正极移动,阴离子从正极相负极移动,从而形成闭合回路。错误.D.NaCl溶液呈中性,所以在烧杯a中发生反应O2 + 2H2O + 4eˉ =4OH-,溶液pH升高。错误。
考点:考查热化学方程式的书写、外界条件对化学平衡的影响、化学平衡常数的含义及应用、原电池工作原理及正误判断的知识。
本题难度:困难
4、选择题 某实验兴趣小组以Zn和Cu为电极,稀硫酸为电解质溶液研究原电池,并对实验进行了拓展,以下实验记录错误的是( )
A.铜片上有气泡产生,锌片逐渐溶解
B.电子在溶液中从Cu电极流向Zn电极
C.把锌片换成石墨,电流计指针没有明显偏转
D.把稀硫酸换成硫酸铜溶液,电流计指针依然偏转
参考答案:以Zn和Cu为电极,稀硫酸为电解质溶液构成的原电池中,金属锌做负极,金属铜做正极.
A、铜片正极上会析出氢气即有气泡产生,负极锌片逐渐溶解,故A正确;
B、电子不能经过电解质,而是沿导线从负极流向正极,故B错误;
C、把锌片换成石墨,仍具备原电池的构成条件,会产生电流,故C正确;
D、以Zn和Cu为电极,硫酸铜为电解质溶液,仍具备原电池的构成条件,可以形成原电池,会产生电流,故D正确.
故选B.
本题解析:
本题难度:一般
5、填空题 (6分)航天飞机常用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-==CO32-+3H2O。
(1)负极上的电极反应为?。
(2)消耗16.8 L(标准状况下)O2时,有?mol 电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度?(填“增大”、“减小”或“不变”)。
参考答案:(1)CH4+10OH――8e―==CO32―+7H2O?(2)3?(3)增大
本题解析:略
本题难度:简单