| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《热化学方程式》高频试题特训(2017年最新版)(二)
参考答案:A 本题解析:根据盖斯定律,(1)-(2)÷2得C(s)+ H2O(g) ="=" CO(g) + H2(g),所以该反应的反应热是-110.5kJ/mol+483.6kJ/mol÷2=+131.3kJ·mol—1。 本题难度:一般 2、填空题 已知下列反应的平衡常数: 参考答案:KΘ= K(1)Θ´K(2)Θ / KwΘ= 0.88 本题解析:根据盖斯定律可知,(1)+(2)-(3)即得到NH3 + HCN 本题难度:一般 3、填空题 (15分)研究碳及其化合物有重要意义。 |
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
参考答案:(15分).
(1)CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=" -130.9" kJ/mol (2分)
(2)①0.042mol/(l·min) (1分) ,②BD (2分),③BE (2分),④36 (2分);
(3)2CO2+ 2H2O =C2H4+3O2(2分)
(4)①2.0×10-2(2分),②CN-+ CO2+ H2O ="HCN+" HCO3-(2分)
本题解析:(1)甲醇燃烧的热化学方程式是CH3OH(l)+3/2O2(g)= CO2(g)+ 2H2O(l) ΔH= -726.5kJ/mol,氢气燃烧的热化学方程式是H2(g)+1/2O2(g)= H2O(l) ΔH= -285.8kJ/mol,根据盖斯定律,将氧气消去,下式乘以3减去上式可得氢气与二氧化碳反应生成甲醇的热化学方程式,答案为CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=" -130.9" kJ/mol;
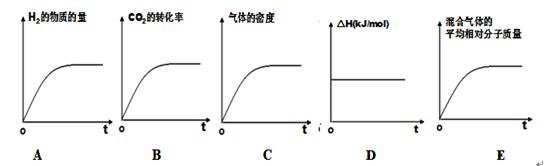
(2)①从反应开始到3min时,甲醇的物质的量增加0.50mol,则水蒸气的物质的量也增加0.50mol,所以H2O(g)的平均反应速率是0.50mol/4L/3min="0.042" mol/(l·min);
②A、使用催化剂,只能加快反应速率,不能改变平衡,所以氢气的转化率不变,错误;B、在原容器中再充入1mol CO2,则反应物的浓度增大,反应速率加快,同时平衡正向移动,则氢气的转化率增大,正确;C、在原容器中再充入1mol He,则容器的压强增大,但各物质的浓度不变,反应速率和平衡都不变,错误;D、缩小容器的体积,则压强增大,反应速率加快,同时平衡正向移动,氢气的转化率增大,正确,答案选BD;
③A、氢气的起始物质的量不是0,与题意不符,错误;B、二氧化碳的转化率逐渐增大,达到平衡时,不再增大,正确;C、因为是恒容条件,气体的密度始终不变,不能判断为平衡状态,错误;D、一个化学反应的反应热只与反应物与生成物的状态有关,所以反应热始终不变,错误;E、该反应是气体的物质的量发生变化的可逆反应,所以气体的平均相对分子质量也发生变化,达到平衡时,不再变化,正确,答案选BE;
④根据图像可知,平衡时甲醇的物质的量是0.75mol,二氧化碳的物质的量是0.25mol,则水蒸气的物质的量是0.75mol,氢气的物质的量是3.25-0.75×3=1mol,根据平衡常数的定义,则该条件下的平衡常数K=(0.75/4)2/(1/4))30.25/4=36;
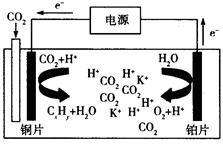
(3)根据电子的移动方向可知,铜极为阴极,铂极为阳极,阴极是二氧化碳得到电子与氢离子结合为乙烯和水,阳极是水失去电子,生成氧气和氢离子,所以总反应是二氧化碳与水反应生成乙烯和氧气,化学方程式是2CO2+ 2H2O =C2H4+3O2;
(4)①因为HCN的电离常数K=4.9×10-10=c(H+) c(CN-)/ c(HCN),pH=11,则c(H+)=10-11mol/L,则c(HCN)/c(CN-)= c(H+)/K=2.0×10-2;
②向NaCN溶液中通入少量CO2,根据表中酸的电离常数可知,酸性:H2CO3>HCN>HCO3-,所以NaCN和碳酸氢钠,不会再生成碳酸钠和HCN,则反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,
考点:考查盖斯定律的应用,化学平衡状态的判断,化学平衡移动的应用,电离常数的应用
本题难度:困难
4、填空题 (10分)工业上制备BaCl2的工艺流程图如图:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s)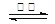 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)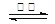 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
A.Na2S溶液的pH比NaHS溶液pH小
B.两溶液中含有的离子种类不同
C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等
D.两溶液中加入NaOH固体,c(S2-)都增大
E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+)
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,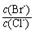 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)反应C(s) + CO2(g)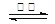 2CO(g)的ΔH =
2CO(g)的ΔH =
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是: (只要求答一条)。
参考答案:(1)S2-+H2O HS-+OH-;D、E;(2)2.7×10-3;(3)+172.5KJ/mol;(4)炭过量使BaSO4充分还原
HS-+OH-;D、E;(2)2.7×10-3;(3)+172.5KJ/mol;(4)炭过量使BaSO4充分还原
本题解析:(1)①BaSO4与焦炭在高温下发生反应产生BaS,BaS与盐酸发生反应:BaS+2HCl=BaCl2+H2S↑。H2S 气体被NaOH溶液吸收得到Na2S。Na2S是强碱弱酸盐,弱酸根离子水解使溶液显碱性。水解的离子方程式为S2-+H2O HS-+OH-。②A.NaHS是H2S 的一级电离产生的,Na2S是H2S 的二级电离产生的,对于多元弱酸来说,一级电离>>二级电离。溶液的酸性主要一级电离决定。根据盐的水解规律:有弱才水解,谁弱谁水解,,越弱越水解,谁强显谁性。所以溶液的碱性Na2S>NaHS。即Na2S溶液的pH比NaHS溶液pH大。错误。B.在两种物质的溶液中都含有Na+、S2-、HS-、H2S、H+、OH-。离子种类相同。错误。C.当向Na2S溶液中加入盐酸时,首先发生S2-+H+=HS-,没有气体产生;然后发生HS-+H+=H2S↑,放出气体。而向NaHS溶液中加入盐酸时立即发生HS-+H+=H2S↑,放出气体。所以两溶液中滴入同体积同浓度的盐酸,产生气体速率不相等。错误。D.当向Na2S和NaHS的溶液中分别加入NaOH溶液时由于增大了OH-离子的浓度,所以水解平衡:S2-+H2O
HS-+OH-。②A.NaHS是H2S 的一级电离产生的,Na2S是H2S 的二级电离产生的,对于多元弱酸来说,一级电离>>二级电离。溶液的酸性主要一级电离决定。根据盐的水解规律:有弱才水解,谁弱谁水解,,越弱越水解,谁强显谁性。所以溶液的碱性Na2S>NaHS。即Na2S溶液的pH比NaHS溶液pH大。错误。B.在两种物质的溶液中都含有Na+、S2-、HS-、H2S、H+、OH-。离子种类相同。错误。C.当向Na2S溶液中加入盐酸时,首先发生S2-+H+=HS-,没有气体产生;然后发生HS-+H+=H2S↑,放出气体。而向NaHS溶液中加入盐酸时立即发生HS-+H+=H2S↑,放出气体。所以两溶液中滴入同体积同浓度的盐酸,产生气体速率不相等。错误。D.当向Na2S和NaHS的溶液中分别加入NaOH溶液时由于增大了OH-离子的浓度,所以水解平衡:S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-逆向移动。使c(S2-)都增大。所以正确。E.NaHS=Na++ HS-; HS-发生水解反应 HS-+H2O
H2S+OH-逆向移动。使c(S2-)都增大。所以正确。E.NaHS=Na++ HS-; HS-发生水解反应 HS-+H2O H2S+OH-要消耗,所以c(Na+) >c(HS-);HS-水解消耗了水电离产生的H+,使H+的浓度减小,最终当达到水的电离平衡时c(OH-) >c (H+) 。盐的电离远大于弱电解质水的电离,所以c(HS-) >c(OH-)。因此E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+) 。正确。(2)向BaCl2溶液中加入AgNO3和KBr,发生反应:Ag++Cl-="AgCl↓;" Ag++Br-=AgBr↓.Ksp(AgBr)= C(Ag+)·C(Br-) =5.4×10-13; Ksp(AgCl)= C(Ag+)·C(Cl-)=2.0×10-10当两种沉淀共存时,C(Ag+)相同。
H2S+OH-要消耗,所以c(Na+) >c(HS-);HS-水解消耗了水电离产生的H+,使H+的浓度减小,最终当达到水的电离平衡时c(OH-) >c (H+) 。盐的电离远大于弱电解质水的电离,所以c(HS-) >c(OH-)。因此E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+) 。正确。(2)向BaCl2溶液中加入AgNO3和KBr,发生反应:Ag++Cl-="AgCl↓;" Ag++Br-=AgBr↓.Ksp(AgBr)= C(Ag+)·C(Br-) =5.4×10-13; Ksp(AgCl)= C(Ag+)·C(Cl-)=2.0×10-10当两种沉淀共存时,C(Ag+)相同。 。(3) (①-②)÷2可得:反应C(s) + CO2(g)
。(3) (①-②)÷2可得:反应C(s) + CO2(g) 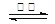 2CO(g)的ΔH =+172.5KJ/mol;(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是使BaSO4充分还原得到BaS。
2CO(g)的ΔH =+172.5KJ/mol;(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是使BaSO4充分还原得到BaS。
考点:考查BaSO4的用途、Na2S和NaHS溶液的比较、溶度积常数的应用及热化学方程式的书写等知识。
本题难度:一般
5、选择题 如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是
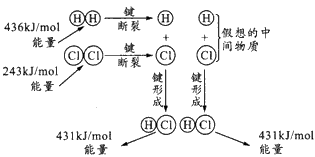
[? ]
参考答案:C
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《物质的组成.. | |