|
|
|
高中化学知识点归纳《热化学方程式》高频试题特训(2017年最新版)(四)
2017-09-25 16:58:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是:______;
(2)PCl5分解成PCl3和Cl2的热化学方程式是:______;
上述分解反应是一个可逆反应.温度T1时,在密闭容器中加入0.80mol?PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2______α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______;
(4)P和Cl2分两步反应生成1mol?PCl5的△H?3=______,P和Cl2一步反应生成1mol?PCl5的△H?4______△H?3(填“大于”、“小于”或“等于”).
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是:______.
参考答案:(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+32Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,热化学方程式为:P(s)+32Cl2(g)═PCl3(g);△H=-306 kJ/mol,
故答案为:P(s)+32Cl2(g)═PCl3(g);△H=-306kJ?mol-1;?
(2)△H=生成物总能量-反应物总能量,Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,所以 PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g);△H=+93 kJ/mol;
PCl5分解率α1=0.8mol-0.6mol0.8mol×100%=25%.PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;升高温度向吸热反应方向移动,正反应(分解反应是吸热反应)是吸热反应,升高温度向正反应方向移动,转化率增大,α2 >α1 ;
故答案为:PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1;25%; 大于;
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解;
(4)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
P(s)+32Cl2(g)=PCl3(g);△H1=-306 kJ/mol,
Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;
P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol,
由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热;
故答案为:-399kJ?mol-1;等于;
(5)PCl5与足量水充分反应,最终生成两种酸磷酸和盐酸,依据原子守恒写出化学方程式为:PCl5+4H2O=H3PO4+5HCl;
故答案为:PCl5+4H2O=H3PO4+5HCl;
本题解析:
本题难度:一般
2、选择题 100g碳粉燃烧所得气体中,CO占2/3、CO2占1/3体积,且C(s)+1/2O2(g)=CO(g)△H=—110.35kJ/mol,CO(g)+1/2O2(g) =CO2(g) △H=—282.57kJ/mol, 与这些碳完全燃烧相比损失的热量是
A.784.92kJ
B.2489.44 kJ
C.1569.83kJ
D.3274.3 kJ
|
参考答案:C
本题解析:100g碳中有2/3的碳只生成了一氧化氮,所以根据盖斯定理,所以损失的是这部分一氧化碳转化二氧化碳的热量。Q=(100/12)*2/3*282.57=1569.83kJ。
考点:盖斯定律
点评:本题关键在于分析损失的热量为其中三分之二一氧化碳燃烧生成二氧化碳的热量。
本题难度:一般
3、简答题 (1)请用热化学方程式表示:
A.1mol?N2(g)与适量H2(g)起反应,生成2mol?NH3(g),放出92.2kJ热量______.
B.1mol?N2(g)与适量O2(g)起反应,生成2mol?NO2(g),吸收68kJ热量______.
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热______(填“大于”、“等于”或“小于”)192.9kJ/mol.已知水的气化热为44kJ/mol,则氢气燃烧热的热化学方程式为______.
参考答案:(1)A.1mol?N2(g)与适量H2(g)起反应,生成2mol?NH3(g),放出92.2kJ热量的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
B.1mol?N2(g)与适量O2(g)起反应,生成2mol?NO2(g),吸收68kJ热量的热化学方程式为N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;
(2)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,而H2O的稳定化合物是液态水,H2O蒸汽转变为液态水需要放热,所以CH3OH的燃烧热大于192.9kJ/mol;
? CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol?①
? CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol? ②
?②-①得?3H2(g)+3/2O2(g)=3H2O(g)△H=-241.9kJ/mol?③
?H2O(l)=H2O(g)△H=+44kJ/mol?④
③-④×3 得?3H2(g)+3/2O2(g)=3H2O(g)△H=-373.9kJ/mol?即H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:大于;H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol.
本题解析:
本题难度:一般
4、选择题 已知下列数据:Fe(s) + 1/2O2(g) = FeO(s) ΔH=-272kJ/mol;2Al(s) + 3/2O2(g) = Al2O3(s) ΔH=-1675kJ/mol;则2Al(s) + 3FeO(s) = Al2O3(s) + 3Fe(s)的ΔH是
A.-859 kJ/mol
B.+859 kJ/mol
C.-1403 kJ/mol
D.-2491 kJ/mol
|
参考答案:A
本题解析:根据反应①Fe(s) + 1/2O2(g) = FeO(s) ΔH=-272kJ/mol;②2Al(s) + 3/2O2(g) = Al2O3(s) ΔH=-1675kJ/mol;可知②-①×3即可得到2Al(s) + 3FeO(s) = Al2O3(s) + 3Fe(s) 所以ΔH=-1675kJ/mol+272kJ/mol×3=-859 kJ/mol,选A。
考点:考查盖斯定律的应用。
本题难度:一般
5、填空题 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: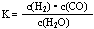 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH="__________" ,
CH3OCH3(g)+CO2(g)的ΔH="__________" ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应 N2O4(g)

2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
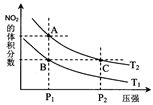
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3。25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加n L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如右图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
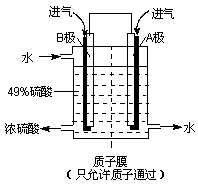
①溶液中H+的移动方向由______ 极到______极;(用A、B表示)
②B电极的电极反应式为__________________________。
参考答案: (1) C(s)+H2O(g)  CO(g)+ H2 (g) (1分)
CO(g)+ H2 (g) (1分)
(2)-246.4KJ/mol (2分) CH3OCH3-12e-+3H2O=2CO2+12H+ (2分)
(3)放热(1分) 75% (2分)
(4)D (2分) (5) 逆向 (2分) m/200n (2分)
(6)①B (1分) A (1分) ②SO2+2H2O-2e-=SO42-+4H+ (2分)
本题解析:(1)煤生成水煤气的反应为C(s)+H2O(g)  CO(g)+ H2 (g)。
CO(g)+ H2 (g)。
(2)观察目标方程式,应是①2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ? mol -1;负极以CH3OCH3和H2O作为原料,失去电子生成CO2和 H+
(3)升高温度,平衡常数减小,平衡左移,故正反应是放热反应;
CO(g)+H2O(g)?CO2(g)+H2(g) 反应是一定体积容器中设为1L,反应量为x
起始量(mol) 0.02 0.02 0 0
变化量(mol) x x x x
所得量(mol)0.02-x 0.02-x x x
根据K= c(CO2) ×c(H2)/( c(CO) × c(H2O) ),得 x2/(0.02-x)2=9,得x=0.015mol
转化率为0.015/0.02×100%=75%
(4)A、从A点到C点,温度相同,但是P2>P1,压强大,化学反应速率快,因此C>A
B、C点的压强大,容器体积小,浓度高,因此C点颜色深。
C、B,C两点的纵坐标数据相同,也就是各气体的体积分数相同,物质的量相同,其平均相对分子质量也相同
D、 该反应为吸热反应(可视为N2O4(g)=NO2(g)+NO2(g),为分解反应,吸热过程)。B到A的过程生产物NO2(g)的体积分数增多,反应正向移动,可以采用加热的方法。
(5)滴加氨水的过程中,将抑制水的电 离。理由是加碱将抑制水的电离,故水的电离平衡将 逆向
.由电荷守恒得:n(NH4+) +n(H+)=n(NO3-) +n(OH-),
由于溶液呈中性,所以n(H+)= n(OH-),n(NH4+) =n(NO3-) =m
NH3H2O=(可逆)=NH4+ +OH-
X m /n 10-7
NH3H2O的店里平衡常数 Kb="c(" NH4+)×c( OH-)/C(NH3H2O)="[" ( m/n )×10-7 ]/x=2×10-5mol·L-1
所以x= m/200n mol·L-1
(6) 阳离子向正极移动,所以H+从B极向A极移动。
根据B极的产物可以看出B极发生氧化反应,是负极,电极方程式为SO2+2H2O-2e-=SO42-+4H+。
考点:考查化学平衡知识
本题难度:困难
 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________ CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
 CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
 CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
 CH3OCH3(g)+CO2(g)的ΔH="__________" ,
CH3OCH3(g)+CO2(g)的ΔH="__________" ,  H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示: 2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。

 CO(g)+ H2 (g) (1分)
CO(g)+ H2 (g) (1分) CO(g)+ H2 (g)。
CO(g)+ H2 (g)。