微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 常温下,两种溶液①0.1mol/L?NH3?H2O?②0.1mol/L?NH4Cl中:
(1)溶液①的pH______?7(填“>”、“<”或“=”),其原因是______(用离子方程式表示).
(2)溶液②呈______?性(填“酸”、“碱”或“中”).水解反应是吸热反应,升温可以______(填“促进”或“抑制”)NH4Cl?的水解.
(3)两种溶液中c(NH4+)?的大小为______(填字母).
a.两种溶液中c(NH4+)?都等于0.1mol/L
b.两种溶液中c(NH4+)?都小于0.1mol/L
c.NH4Cl溶液中c(NH4+)?小于NH3?H2O溶液中c(NH4+)
参考答案:(1)氨水是弱碱,在水溶液能电离出氢氧根离子,导致氢氧根离子浓度大于氢离子浓度,溶液呈碱性,溶液的pH>7,电离方程式为:NH3?H2O?NH4++OH-,
故答案为:>;NH3?H2O?NH4++OH-;
(2)氯化铵是强酸弱碱盐,能水解导致溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性;盐类水解反应是吸热反应,升高温度平衡向正反应方向移动,所以能促进水解,
故答案为:酸;促进;
(3)氨水是弱电解质,在水中电离程度很小;氯化铵是强酸弱碱盐,能水解但水解程度很小,主要以电离为主,所以相同浓度的氨水和氯化铵溶液,氯化铵溶液中铵根离子浓度较大,但都小于0.1mol/L,故选b.
本题解析:
本题难度:一般
2、选择题 草酸是二元中强酸,测得0.01 mol·L-1的草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是
A.V(NaOH) = 0时, c(Na+)> c(H+)> c(HC2O4- )> c(C2O42-)> c(OH-)
B.V(NaOH) = 5时, c(Na+)=c(C2O42-)+c(HC2O4- )+c(H2C2O4)
C.V(NaOH) =" 10" mL时, c(Na+) = c(HC2O4- )+2c(C2O42-)
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
参考答案:D
本题解析:A选项c(Na+)> c(HC2O4- ) > c(H+) > c(OH-)>c(C2O42-)
B选项物料守恒不正确;C选项电荷守恒不正确
本题难度:一般
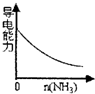
3、选择题 下列实验过程中产生的现象与对应的图形正确的是( )
A.NaAlO2溶液中加入盐酸
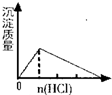
B.SO2气体通入溴水中

C.pH=2的醋酸与盐酸溶液分别加水稀释
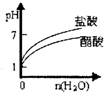
D.氨气通入醋酸溶液中
参考答案:A.在NaAlO2溶液中加入盐酸,发生反应分别为AlO2-+H++H2O═Al(OH)3↓,Al(OH)3↓+3H+═Al3++3H2O,反应开始时有沉淀生成,然后沉淀溶解,故A正确;
B.SO2气体通入溴水中,发生反应Br2+SO2+2H2O═H2SO4+2HBr,反应后溶液酸性增强,pH减小,但溴水溶液呈酸性,开始时pH<7,故B错误;
C.醋酸为弱酸,加水稀释时进一步电离,pH变化较盐酸小,但无论怎么稀释,溶液都成酸性,不可能呈碱性,故C错误;
D.氨气通入醋酸溶液中,反应生成强电解质醋酸铵,溶液导电能力增强,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。有关说法正确的是

A.a、b、c三点溶液的pH:a>b>c
B.若使C点的醋酸根离子浓度增大,溶液的pH也增大,可加入适量的醋酸钠固体
C.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D.用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
参考答案:B
本题解析:略
本题难度:一般
5、填空题 (1)某温度(t℃)时,水的Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b___________;
②若所得混合液的pH=2,则a∶b___________;
(2)将等体积的氨水与盐酸溶液混和后,若混和溶液中c(NH4+)=c(Cl-),则溶液中的pH值________7,混和前c(NH3·H2O)________c(HCl),氨水中c(OH-)________盐酸中c(H+)。(填>、<或=,下同)
参考答案:(1)10∶1;9∶2
(2)=;>;<
本题解析:
本题难度:一般