微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠四瓶失去标签的溶液,分别编号为A、B、C、D每次取少量溶液两两混合,所观察到的现象如表,“一”表示无明显现象;“↓”表示有沉淀生成;“↑”表示有气体生成。
(1)则A ,B ,
C ,D ;(写化学式)
(2 )写出实验过程中有关物质间反应的离子方程式
)写出实验过程中有关物质间反应的离子方程式
B +C
参考答案:(1)则A:H2SO4,B:Na2CO3 C:Ba(OH)2 D:HCl
(2)Ba2++ CO32-===BaCO3↓
CO32-===BaCO3↓
本题解析:略
本题难度:一般
2、填空题 进行污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 ,
萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是 。
(2)如图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
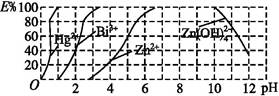
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH= 。
②当调节pH=2时,铋(Bi)的存在形式有 ,其物质的量之比为 。
③萃取到CCl4中的Zn(HDz)2分液后,加入足量NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
(3)污水中的亚汞离子(H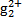 )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H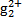 生成硫酸汞,写出该反应的化学方程式: 。
生成硫酸汞,写出该反应的化学方程式: 。
参考答案:(1)F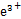 +3H2Dz
+3H2Dz Fe(HDz)3+3H+ Fe3+会形成Fe(OH)3沉淀
Fe(HDz)3+3H+ Fe3+会形成Fe(OH)3沉淀
(2)①1 ②Bi3+、Bi(HDz)3 B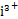 ∶Bi(HDz)3=3∶2
∶Bi(HDz)3=3∶2
③Zn(HDz)2+6OH- Zn(OH
Zn(OH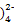 +2Dz2-+2H2O
+2Dz2-+2H2O
(3)Hg2Cl2+K2S2O8 2HgSO4+2KCl
2HgSO4+2KCl
本题解析:(2)pH=2时Bi萃取分离的百分率40%,有40%的Bi以Bi(HDz)3的形式存在,60%的Bi以Bi3+的形式存在;③由图像可知pH>10时,Zn(HDz)2开始转化为Zn(OH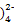 ,H2Dz属于二元弱酸,最终以Dz2-形式存在
,H2Dz属于二元弱酸,最终以Dz2-形式存在
本题难度:困难
3、选择题 能正确表示下列反应的离子方程式是

参考答案:A
本题解析:B中生成HCl;C中原子H个数不守恒;D中生成AlO2-。答案选A。
本题难度:一般
4、填空题 (10分)甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
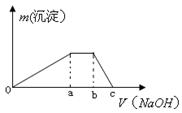
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示;
④取少量甲溶液于试管中,加入过量NaOH溶液并加热;
回答下列问题:
(1) D在周期表中的位置 写出化合物AB3的电子式
(2)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比1:1,且1 mol 甲晶体中含有12 mol结晶水。则甲晶体的化学式为 。
(3)实验③中根据图像得V(Oa):V(ab):V(bc)= 。
(4)实验④中离子方程式是 。
参考答案:(l) 第3周期ⅥA族 ;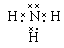 ;(2)NH4Al(SO4)2·12H2O[或AlNH4(SO4)2·12H2O] ;(3)3:1:1;
;(2)NH4Al(SO4)2·12H2O[或AlNH4(SO4)2·12H2O] ;(3)3:1:1;
(4) NH4++Al3++5OH— NH3↑+Al(OH)4—+H2O 或NH4++Al3++5OH—
NH3↑+Al(OH)4—+H2O 或NH4++Al3++5OH— NH3↑+AlO2—+3H2O。
NH3↑+AlO2—+3H2O。
本题解析:根据题意可推知:A是N元素;B是H元素;C是Al元素;D是S元素;E是O元素。(1) D在周期表中的位置是位于第三周期第ⅥA族;化合物AB3的电子式是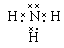 ;(2)根据元素形成的化合物的特点及该盐的相对分子质量可知该化合物是NH4Al(SO4)2·12H2O[或AlNH4(SO4)2·12H2O] ;(3)由于在该盐中,n(Al3+):n(NH4+):n(SO42-)=1:1:2.向该化合物的溶液中加入NaOH溶液,首先发生反应:Al3++3OH-=Al(OH)3↓;然后发生反应:NH
;(2)根据元素形成的化合物的特点及该盐的相对分子质量可知该化合物是NH4Al(SO4)2·12H2O[或AlNH4(SO4)2·12H2O] ;(3)由于在该盐中,n(Al3+):n(NH4+):n(SO42-)=1:1:2.向该化合物的溶液中加入NaOH溶液,首先发生反应:Al3++3OH-=Al(OH)3↓;然后发生反应:NH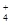 + OH-=NH3·H2O;最后发生反应:Al(OH)3+ OH-=AlO2-+ 2H2O。因此在实验③中根据图像得V(Oa):V(ab):V(bc)=3:1:1。(4)由于氢氧化铝是两性氢氧化物,能够与过量的强碱发生反应,所以实验④中离子方程式是NH4++Al3++5OH—
+ OH-=NH3·H2O;最后发生反应:Al(OH)3+ OH-=AlO2-+ 2H2O。因此在实验③中根据图像得V(Oa):V(ab):V(bc)=3:1:1。(4)由于氢氧化铝是两性氢氧化物,能够与过量的强碱发生反应,所以实验④中离子方程式是NH4++Al3++5OH— NH3↑+Al(OH)4—+H2O 或NH4++Al3++5OH—
NH3↑+Al(OH)4—+H2O 或NH4++Al3++5OH— NH3↑+AlO2—+3H2O。
NH3↑+AlO2—+3H2O。
考点:考查元素及化合物的推断、实验现象的分析、化学方程式、离子方程式、化合物的电子式的书写。
本题难度:困难
5、选择题 下列实验操作中离子反应方程式错误的是( )
A.向NaHCO3溶液中滴加少量澄清石灰水; Ca2++2OH