微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组金属均有导线相连,并插入对应的液体中,其中不能组成原电池的是
A.Zn ∣H2SO4(稀)∣Fe
B.Cu ∣ AgNO3(aq)∣ Ag
C.Zn ∣ CCl4∣ Cu
D.Fe ∣ H2SO4(稀) ∣ Fe
参考答案:C
本题解析:C中四氯化碳不是电解质溶液,不能构成原电池。
点评:一般来说,形成原电池需满足以下条件:活泼性不同的两个电极、闭合回路、电解质溶液。
本题难度:一般
2、选择题 下列叙述中,可以说明金属甲比乙活泼性强的是
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出
B.在氧化还原反应中,甲比乙失去的电子多
C.将甲乙作电极组成原电池时甲做负极
D.将甲乙作电极组成电解池时甲做正极
参考答案:C
本题解析:A 根据题意可知,甲乙两种金属之间构成原电池,根据甲有有H2气放出,为正极,乙溶解为负极,故乙比甲活泼性强,故A错误;B、在氧化还原反应中,活动性强弱与失去电子的难易有关,与失去电子的多少无关,所以B错误;C在原电池和电解池中,金属性的强弱除与电极本身有关,一般情况,活泼金属为负极,D错,故选C。
点评:本题是高考中的热点问题,一般来说,比较两种金属的金属的活泼性还可以从以下几个方面来考虑:
1.与酸或水反应的剧烈程度,越剧烈越活泼;
2.金属之间的置换。换句话说,(1)就是金属活动性强的从金属活动性弱的盐溶液中将金属活动性弱的金属置换出来。(2)是在金属活动性顺序表中,前者的金属性强于后者。
3.金属对应的最高价氧化物的水化物碱性强弱,碱性越强,金属性越强。
4.金属阳离子的氧化性越强,则单质的还原性越弱,元素的金属性越弱。
本题难度:一般
3、填空题 理论上任何自发的氧化还原反应都可以设计成原电池。现使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池。?
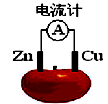
(1)该电池的负极材料是__________,负极反应式:____________;
(2)现有如下材料设计类似的水果电池,并使电流计发生明显偏转。
酸性水果:柠檬、柑橘、橙子等
碱性水果:柿子、葡萄等
电极:A.镁条、B.铝片、C.铜片、D.碳棒。
①若选择酸性水果组装水果电池,负极材料可以是:___________(填所有可能的电极选项)正极反应式为:____________
②若选择碱性水果组装水果电池,正极材料可以是:____________(填所有可能的电极选项)假设水果的碱性较强,电池的负极反应式为:_____________?
(3)原电池的电解质溶液也可以呈中性,例如为海洋中的航行灯提供电能的就是由铝、空气、海水构成的原电池,该电池总反应为4Al+3O2+6H2O=?4Al(OH)3,写出该电池的正极反应式___________。
参考答案:(1)?锌或Zn ;Zn-2e-=Zn2+?
(2)?①:AB;2H++2e-=H2↑; ②:ABD;Al-3e-+4OH-=?AlO2-+2H2O
(3)?O2+4e-+2H2O=?4OH-
本题解析:
本题难度:一般
4、选择题 将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
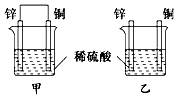
[? ]
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列关于电解的说法中,正确的是( )
A.电解池是把化学能转变为电能的装置
B.电解精炼铜时,粗铜板做阴极
C.电镀时,通常把待镀的金属制品做阴极
D.工业电解饱和食盐水用于生产金属钠和氯气
参考答案:A.电解池中电能转化为化学能,则电解池是把电能转变为化学能的装置,故A错误;
B.电镀时粗铜作阳极,则电解精炼铜时,粗铜板做阳极,故B错误;
C.电镀时,镀件作阴极,则电镀时,通常把待镀的金属制品做阴极,故C正确;
D.工业电解饱和食盐水生成NaOH、氢气、氯气,电解熔融的氯化钠可得到钠和氯气,故D错误;
故选C.
本题解析:
本题难度:简单