微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (一)某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:

(1)浓硫酸的作用是______.
(2)B中观察到的实验现象是______.
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理______
(二)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的微粒是______.上述溶液逐渐褪去,起作用的微粒是______.
加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的微粒是______.
(三)在标准状况下,35.5g氯气的体积是______L,将其与氢气完全化合,需氢气的物质的量是______mol,将生成的气体制成1L溶液,溶质的物质的量浓度是______mol?L-1,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是______mol?L-1.
参考答案:(一)(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气,
故答案为:除去氯气中的水蒸气;
(2)干燥氯气不具有漂白性,装置B中的有色布条不褪色;
故答案为:不褪色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,装置图为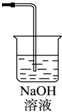 ;
;
故答案为: ;Cl2+2NaOH=NaCl+NaClO+H2O;
;Cl2+2NaOH=NaCl+NaClO+H2O;
(二)酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;
次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子;
银离子和氯离子能生成不溶于稀硝酸的白色沉淀,所以加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是氯离子.
故答案为:H+;HClO;Cl-;
(三)在标准状况下,35.5g氯气的体积是V=n×Vm=mM×Vm=35.5g71g/mol×22.4L/mol=11.2L;
由H2~Cl2~2HCl可知n(H2)=n(Cl2 )=35.5g71g/mol=0.5mol;n(HCl)=2n(Cl2 )=1mol;
将生成的气体制成1L溶液,溶质的物质的量浓度是1mol1L=1mol/L;
设稀释后溶液的浓度为C,则1mol/L×20mL=C×200mL,解得:C=0.1mol/L;
故答案为:11.2;0.5;1;0.1.
本题解析:
本题难度:一般
2、选择题 下列各组物质中,X是主体物质,Y是其中含有的少量杂质,Z是为除去杂质而加入的试剂,其中能达到除杂目的组别是( )
| X | Y | Z
A
FeCl2溶液
FeCl3
KSCN溶液
B
CO2
HCl
饱和Na2CO3溶液
C
KCl溶液
MgCl2
适量NaOH溶液
D
FeCl2溶液
CuCl2
Fe粉
|
A.A
B.B
C.C
D.D
参考答案:A.加KSCN溶液可鉴别,不能除杂,则除杂氯化亚铁溶液中的氯化铁,应选择铁粉,故A错误;
B.二者均与碳酸钠溶液反应,不 能除杂,则应选饱和碳酸氢钠溶液,故B错误;
C.引入新杂质钠离子,则应选择适量的KOH溶液除杂,故C错误;
D.Fe与氯化铜反应生成氯化亚铁和Cu,则利用Fe粉可除杂,不会引入新杂质,故D正确;
故选D.
本题解析:
本题难度:简单
3、实验题 某研究性学习小组探究NO3-在不同环境中的氧化性。
(1)实验一:
①试管a、b中均加入等浓度、等体积的NaNO3溶液和等质量的铜片,加热,无明显现象;
② 向试管a中加入V mL NaOH溶液,加热,无明显现象;
③向试管b中加入V mL稀H2SO4,加热,可观察到的现象是___________。
实验一的目的是___________。
(2)实验二:利用如图装置探究不同浓度HNO3的氧化性。
①已知电流计指针偏转方向是电子移动方向。将铜、铁两极同时插入浓HNO3中,观察到电流计指针指向铜,但迅速反转,指针偏向铁一端,此时铁作极_________(填“正”或“负”);指针反转的原因是__________
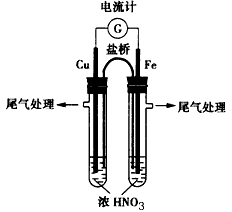
②将浓HNO3改为稀HNO3后,观察到电流计指针指向铜,此时正极反应式是_______________。
参考答案:(1)③铜溶解,生成无色气体,溶液由无色变蓝色;探究NO3-在酸、碱性溶液中的氧化性
(2)①正;铁在浓硝酸中迅速氧化,在其表面形成致密的氧化膜,阻碍了内层铁进一步与浓硝酸反应(铁在浓硝酸中钝化);②NO3-+4H++3e-=NO↑+2H2O
本题解析:
本题难度:一般
4、实验题 (共22分)某实验小组用下列装置进行如下的实验。?
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
?、?。
实验小组在不断鼓入空气的情况下,熄灭酒精灯,发现反应仍能继续进行,说明该反应是? ? ?反应。
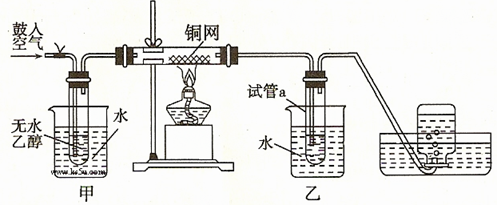
(2)甲和乙两个水浴作用不相同。甲的作用是?;
乙的作用是?。
(3)反应进行一段时间后,干燥的試管a中能收集到不同的物质,那么收集到的有机物是(请填写其结构简式)?;集气瓶中收集到的气体的最主要成分是?。(填写气体的分子式)
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,实验小组的同学认为这可能是存在副产物乙酸。除去该物质,可以使用厨房中常见的一种化合物,该物质为? 。(填写化学式或分子式)
。(填写化学式或分子式)
(5)请写出以上实验涉及的有机物乙醇在生活生产中的一种具体应用:?。
(6)该实验的目的是:?
参考答案:(1)(6分)2Cu+O2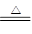 2CuO? CH3CH2OH+CuO
2CuO? CH3CH2OH+CuO CH3CHO+Cu+H2O?放热反应
CH3CHO+Cu+H2O?放热反应
(2)(4分)加热?冷却?(3)(6分)乙醛?乙醇?氮气?
(4)(2分)Na2CO3或NaHCO3?
(5)(2分)如:乙醇用来消毒等;(6)(2分)探究乙醇催化氧化实验
本题解析:考查乙醇催化氧化原理
(1)红色是铜的颜色,黑色是氧化铜的颜色。说明在加热的条件下铜被空气氧化生成氧化铜,氧化铜在加热的条件下又被乙醇还原生成了铜。熄灭酒精灯后,反应仍然能进行,说明反应是放热反应,放出的热量足以维持反应的进行。
(2)根据装置可判断,进入玻璃管的是乙醇气体,所以通过加热使乙醇挥发,产生乙醇气体。而要得到生成物乙醛,就必须降低温度,使乙醛液化变成液体,便于收集。
(3)反应连续进行的,即部分乙醇来不及被氧化,和生成的乙醛一同进入小试管中。而空气中的氮气难溶于水,且不参与反应,被收集到集气瓶中。
(4)试纸显红色,说明溶液显酸性,这说明在反应过程中有乙酸生成,所以要除去乙酸,可以用碳酸氢钠或碳酸钠溶液即可。
(5)75%的酒精溶液,常原来作消毒剂。
(6)根据实验原理及装置可知实验目的是来探究乙醇催化氧化实验的。
本题难度:一般
5、简答题 学习元素周期律后,某研究性学习小组的同学们对第四周期过渡元素的氧化物产生了浓厚的兴趣.在已知二氧化锰对氯酸钾催化分解知识的基础上,联想到氧化铁、氧化铜、氧化铬等对氯酸钾的分解是否有催化作用,对此他们进行了实验研究.
请根据要求完成下列部分实验报告:
(1)课题名称:______.
(2)实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、______等.
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
(3)实验步骤:略
(4)实验数据:
实验
编号 | KClO3/g | 氧化物 | 产生气体/mL
(已折算到标况) | 耗时/s
化学式
质量/g
回收
1
0.60
-
-
-
10
480
2
0.60
MnO2
0.20
90%
67.2
36.5
3
0.60
CuO
0.20
90%
67.2
79.5
4
0.60
Fe2O3
0.20
90%
67.2
34.7
5
0.60
Cr2O3
0.20
90%
67.2
188.3
|
(5)实验讨论:
①在氧化物的回放过程中,要进行的操作是溶解、______、洗涤、______、称量.
②实验编号3的实验中KClO3的分解率为______(保留一位小数).
③在和Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气味的气体是______,可用______试纸检验.上述异常现象产生的原因是______.
(6)实验结论______.
参考答案:(1)本实验的目的是探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用,所以其课题名称为探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解反应的催化作用.
故答案为:探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用;
(2)试根据实验要测定时间,所以应有秒表,还有反应容器和加热仪器,故答案为:试管、酒精灯、秒表;
(5)①CuO、Fe2O3、Cr2O3都难溶于水,所以回收是要溶解、洗涤、过滤、干燥、称量,
故答案为:过滤、干燥;
②生成氧气的物质的量为n=VVm=0.0672L22.4L/mol=0.003mol,
2KCl3?CuO?.△2KCl+3O2↑
2mol?3mol?
0.002mol? 0.003mol
所以反应的氯酸钾的物质的量为?0.002mol,质量为m=nM=0.002mol×122.5g/mol=0.245g,
所以其分解率为0.245g0.6g×100%=40.8%,
故答案为:40.8%;
③用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾与氧化铬发生了氧化还原反应,生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl2;湿润的淀粉碘化钾;KClO3与Cr2O3发生了氧化还原反应;
(6)根据图表中回收的氧化物及耗时分析,CuO、Cr2O3?与二氧化锰比较,耗时较长且Cr2O3?的回收物有异常,氯化铁和二氧化锰的催化能力相近.
故答案为:Fe2O3、CuO能对KC1O分解起催化作用.
本题解析:
本题难度:一般