微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如右图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,
立即用另一表面皿扣在上面。下列对实验现象所做的解释正确的是

A.浓盐酸附近产生白烟:NH3与HCl气体反应产生了NH4C1固体
B.浓硫酸附近无明显现象:NH3与浓硫酸不发生反应
C.氯化物溶液变浑浊:该溶液一定是A1Cl3溶液
D.湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性
参考答案:AD
本题解析:浓盐酸附近产生白烟:NH3与HCl气体反应产生了NH4C1固体。浓硫酸附近有明显现象,B错误。氯化物溶液变浑浊,很多离子在碱性条件下沉淀。湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性
本题难度:一般
2、实验题 某废水样品中含有一定量的K+、HCO3—、SO32—,甲、乙两研究小组欲测定其中SO32—的浓度。
甲组方案:

乙组方案:
①用烧杯盛取废水适量,加适量活性炭除色;过滤,取滤液。
②精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定(有关反应为2MnO4—+5SO32—+6H+=2Mn2++5SO42—+3H2O)。
③记录数据,计算。
(1)甲组方案中的“试剂X”可选用________。
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 KOH溶液
c.新制氯水
d.NaI溶液
(2)甲组方案中,加入试剂X后生成SO42—的离子方程式为________________。
(3)甲组方案中,第③步的“系列操作”包含的操作名称依次为__________________。
(4)为乙组方案设计的下列滴定方式中,最合理的是________(填字母序号),达到滴定终点时可观察到的现象是__________________。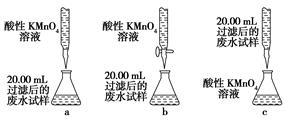
参考答案:(1)c
(2)SO32—+Cl2+H2O=SO42—+2Cl-+2H+
(3)过滤、洗涤、干燥
(4)b 溶液由无色变为紫红色
本题解析:(1)加入试剂X后所得溶液中含有SO42—,故试剂X为氧化剂,排除选项b、d;由于最后需要测定SO42—,故不能用含有SO42—的高锰酸钾溶液,排除a;新制氯水具有氧化性,且对后续定量实验没有影响,合理选项为c。(2)新制氯水中含有Cl2,能够将SO32—氧化为SO42—,而本身被还原为Cl-。(3)经第①步、第②步操作后产生沉淀,故第③步操作为过滤,然后对滤渣进行洗涤,干燥。(4)高锰酸钾具有强氧化性,容易腐蚀碱式滴定管的橡胶管,故高锰酸钾应该用酸式滴定管盛装,a错;乙组方案第②步中提示“精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定”,故锥形瓶中应盛装废水试样,而滴定管中应该盛高锰酸钾溶液,c错。
本题难度:困难
3、实验题 某同学设计了下图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
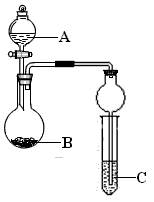
(1)若A为浓氨水,B为烧碱,C为AlCl3溶液,打开分液漏斗旋塞,烧瓶中即有氨气生成,原因是__________ (结合离子方程式回答)。一段时间后,观察到试管中的现象是___________ ,发生反应的离子方程式是______________ 。
(2)利用该装置设计实验证明醋酸、碳酸、苯酚的酸性强弱,若B为碳酸钠,A与B发生反应的离子方程式是____________ ,能得到的相应结论是_____________ ;试管中出现浑浊,依据此现象能否得出相应的结论,请简述理由:_______________ 。
参考答案:(1)在氨水中有下列平衡:NH3+H2O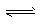 NH3· H2O
NH3· H2O 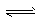 NH4++OH-, NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;有白色沉淀产生;
NH4++OH-, NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;有白色沉淀产生;
Al3+ +3 NH3 · H2O == Al(OH)3↓ + 3 NH4+
(2)CO32-+2CH3COOH→2CH3COO- + H2O+CO2↑;醋酸酸性强于碳酸;不能,因为醋酸具有挥发性,挥发出的醋酸也可以和苯酚钠溶液发生反应,生成苯酚
本题解析:
本题难度:一般
4、填空题 类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3、,但当铁过量时,产物是 Fe ( NO3 ) 2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
( 1 )提出假设: A 是 FeCl3, B 是 FeCl 2。
( 2 )设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。

( 3 )根据上述实验结论,写出 C12与铁粉加热时发生反应的化学方程式:
_________________________________________________________________。
( 4 )为进一步探究 FeC13溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____________________。
A.将 A 溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加 Na OH 浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到 FeC13固体
( 5 )实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加人过量的铁粉,充分反应后,过滤。在所得滤渣中加人足量的盐酸,充分反后,再过滤即得到铜。方案1 中涉及的四种阳离子的氧化性由强到弱的顺序为:
_____________________________________。
方案2 :在废液中加人适量的盐酸调节溶液的 pH =" 1" ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。方案 2 中铜作_________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)___________________________________________________
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:_____________________________________________________。
参考答案:(2)溶液变红色(1分) FeCl2 ( 1 分) ( 3 ) 2Fe十3Cl2 2FeCl3 ( l 分)
2FeCl3 ( l 分)
( 4 ) BD (2分) ( 5 )方案 1 : Fe3+ >Cu2+ > H + > Fe2+ ( l 分)
方案 2 :阴( l 分)2Fe 3++2e一=2Fe2+ ;
Cu2+ + 2e一=Cu ( l 分);
2H + + 2e一=H2↑; ( l 分)
①污染性气体 C12产生( l 分)②使用了电解装置,成本较高等。( l 分)
本题解析:Fe3+遇SCN一变红色。 Fe2+能使 KMnO4溶液褪色; FeC13溶液加人铁粉,将三价铁还原为二价铁,颜色变浅; FeC13溶液加热蒸干最后得到的是三氧化二铁, ( 5 )向废液中加人过量的铁粉,铁粉首先和三价铁离子反应,将其转化为二价铁离子,然后和铜离子反应,再加人盐酸,盐酸和过量的铁粉反应生成二价铁离子,由此知四种离子的氧化性由强到弱的顺序为Fe3+ >Cu2+ > H+ >Fe2+,方案 2 中用铜作阴极,电极上的反应为2Fe3++2e一=2Fe2+,然后 Cu2++2e一=Cu , 2H+十2e一=H 2↑ , 不足之处,阳极会产生氯气污染,会消耗大量的电能等。
本题难度:一般
5、选择题 仅用下表提供的仪器和药品,就能达到相应实验目的的是、
编号
| 仪器
| 药品
| 实验目的
|
A
| 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒
| NaCl固体、蒸馏水
| 配制一定质量份数的NaCl溶液
|
B
| 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞
| 盐酸、大理石、碳酸钠溶液
| 证明非金属性:Cl>C>Si
|
C
| 酸式滴定管、胶头滴管、铁架台(带铁夹)
| 已知浓度的盐酸、待测NaOH溶液
| 测定NaOH溶液的物质的量浓度
|
D
| 烧杯、分液漏斗、胶头滴管、铁架台
| 待提纯的AlCl3溶液,NaoH溶液
| 提纯混有MgCl2杂质的AlCl3溶液
参考答案:A
本题解析:A、药匙用于取用固体,托盘天平称量固体质量,烧杯用于溶解固体,量筒量取水的体积,玻璃棒用于搅拌,可以配制一定质量分数的溶液,正确;B、该实验可以证明盐酸与碳酸酸性的强弱,不能证明非金属性的强弱,错误;C、缺少指示剂和锥形瓶、碱式滴定管,不能作滴定实验,错误;D、缺少普通漏斗、滤纸,不能过滤,错误,答案选A。
本题难度:一般
|