微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe由+2价转为+3价?
②O2被还原、
③产生H2、
④Fe(OH)3失水形成Fe2O3-xH2O、
⑤杂质碳被氧化.
A.①②③④
B.只②③④
C.只①②
D.①②③④⑤
参考答案:钢铁生锈的过程是金属铁发生了吸氧腐蚀(或是析氢腐蚀)的原电池原理,铁为负极,发生失电子的氧化反应,Fe-2e-=Fe2+,正极上是氧气得电子发生还原反应,2H2O+O2+4e-=4OH-,O2被还原,或是在酸性环境下,氢离子得电子的过程,会产生氢气,氢氧化亚铁易被氧气氧化为氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe由+2价转为+3价,最后Fe(OH)3失水形成Fe2O3?xH2O,即为铁锈的成分.
故选A.
本题解析:
本题难度:一般
2、填空题 (12分)研究钢铁的腐蚀与防护具有非常重要的意义。
(1)铁的电化学腐蚀包括两种,这两种腐蚀的负极反应均为?,而正极反应由铁表面的水膜酸碱性决定,当水膜酸度较高时,正极反应式为?,这种腐蚀称为?腐蚀,而水膜酸性不强时,正极反应式为?,这种腐蚀称为?腐蚀。
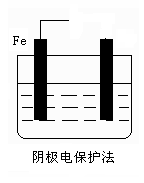
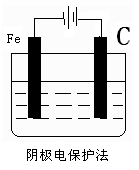
(2)防止钢铁腐蚀的电化学方法有两种,下图中液体为海水,请在图中添加必要的导线、电源,注明另一电极的电极材料名称,使其符合图下所注的保护方法:
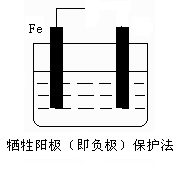 ?
?
参考答案:(1)(电极反应式每个2分,其他每个1分)
Fe -2e– =Fe2+?2H++ 2e– = H2↑?析氢?O2+2H2O+ 4e– =4OH–?吸氧
(2)(毎图2分)
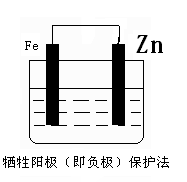 ?
?
本题解析:考查金属的腐蚀与防护
(1)金属发生电化学腐蚀,金属均是失去电子,作负极,反应式是Fe -2e– =Fe2+ 。当水膜酸度较高时,发生析氢腐蚀,正极反应式为2H++ 2e– = H2↑;而水膜酸性不强时,则发生吸氧腐蚀,正极反应式为O2+2H2O+ 4e– =4OH–。
(2)电化学防止金属腐蚀的方法有两种,分别是牺牲阳极的阴极保护法和外加电流的阴极保护法。因此左图中需要一种金属性强于铁的,例如锌;而右图中铁应该作阴极,和电源的负极相连,所以正确的图示是 ?
?
本题难度:一般
3、选择题 化学在生产和日常生活中有着重要的应用。下列说法不正确的是

A.钢铁的腐蚀过程绝大多数都是电化学腐蚀

B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率

C.电解CuCl2饱和溶液,生成金属铜和氯气

D.电解MgCl2饱和溶液,可制得金属镁
参考答案:D
本题解析:金属腐蚀大部分属于电化学腐蚀,A正确。B属于牺牲阳极的阴极保护法,正确。电解CuCl2饱和溶液,阴极氯离子放电生成氯气,阳极铜离子放电析出铜,C正确。镁属于活泼性金属,在水溶液中镁离子不能放电,只有电解熔融MgCl2才可制得金属镁,答案D。
本题难度:一般
4、实验题 Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是?。电池工作时,电子流向?(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是?
?。欲除去Cu2+,最好选用下列试剂中的?(填代号)。
a.NaOH? b.Zn? c.Fe? d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是?。若电解电路中通过2mol电子,MnO2的理论产量为?克。
参考答案:(1)在450 ℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ(没写“在450℃时”得1分,没写温度通常是指“25℃”);(2分)
℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ(没写“在450℃时”得1分,没写温度通常是指“25℃”);(2分)
(2)2CO (g) + SO2 (g)="S" (s) +2CO2 (g) ?△H=-270kJ/mol(3分)(错任何一处不得分)
本题解析:略
本题难度:简单
5、填空题 (8分)[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会?(选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:?。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
序号
| 反应
| 平衡常数
|
1
| Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
| << 1
|
2
| Au3+ + 4Cl— =? AuCl4—
| >>1
|
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因?。
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:
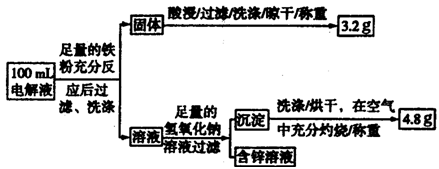
则100mL滤液中Cu2+的浓度为?mol·L—1,Fe2+的浓度为?mol·L—1
参考答案:31.(8分)(1)变小(1分)(2)3Ag+4H++NO-3==3Ag++NO ↑+2H2O(1分)
(3)浓盐酸中含大量Cl-,Au3+与Cl-1形成稳定AuCl-4,使反应2平衡向右移动,促使反应1向右进行,则金溶于王水(2分)
(4)0.5 mol/L) 2分)0.6mol/L(2分)
本题解析:
分析:步骤一:根据电解精炼铜时,阳极和阴极所发生的反应来回答;
步骤二、(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水;根据化学平衡移动原理来分析金能够溶于王水的原因;
(2)根据化学反应原理来计算回答.
解答:解:步骤一:在电解精炼铜时,阳极反应是金属锌、铁、镍等先失电子,而此时阴极上是铜离子已经得电子,即铜离子已经减小了而还未在阳极上产生铜离子,故答案为:变小;
步骤二:(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3-=3Ag++NO↑+2H2O,根据表中的信息,Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl-=AuCl4-,在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中,
故答案为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中;
(2)100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,所以铜离子的浓度c=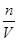 =
=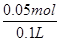 ="0.5" mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是:
="0.5" mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是: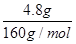 ×2
×2
=0.06mol,所以亚铁离子的浓度c=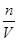 =
=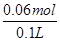 =0.6mol/L,故答案为;0.5;0.6.
=0.6mol/L,故答案为;0.5;0.6.
点评:本题涉及有关电解精炼铜、化学平衡移动原理以及物质的含量的测定的综合知识,考查角度广,难度较大.
本题难度:一般