微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l) HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是

A.温度升高,该反应的平衡常数减小
B.0?10min,HCOOCH3的平均反应速率 u="0." 003mol·L-1 ? min-1
C.HCOOCH3平均反应速率先是增大,后减小,最后保持不变
D.80min时,反应刚达平衡,反应物转化率保持不变
参考答案:C
本题解析:甲酸甲酯的水解是吸热反应,升高温度平衡正向移动,平衡常数增大,A错;因题目中溶液体积V不确定,因此反应速率无法计算,B错。从甲酸甲酯转化率图像看,甲酸甲酯的转化率单位时间内先增大后减小,最终不变,因此反应速率先增大后减小,最终不变,C正确;75min时反应已经达到平衡,D错。
本题难度:一般
2、选择题 合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%。最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨,反应方程式可表示为N2+3H2→2NH3,有关说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.新的催化剂升高了反应所需要的能量,提高了活化分子百分数
参考答案:B
本题解析:氨的合成都是放热反应,A不正确;化学反应的实质就是化学键断裂和形成的过程,C不正确;催化剂降低反应的活化能,从而加快反应速率,D不正确,因此答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导和效率。该题结合新科技、新技术,有利于调动学生的学习兴趣和学习积极性,激发学生学习化学的积极性。
本题难度:一般
3、选择题 下列说法中可以说明2HI(g) H2(g)+I2(g)已达到平衡状态的是(?)
H2(g)+I2(g)已达到平衡状态的是(?)
(1)单位时间内生成n mol H2的同时生成n mol HI
(2)一个H—H键断裂的同时有两个H—I键断裂
(3)c(HI)= c(I2)
(4)反应速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)温度和体积一定时,某一生成物浓度不再变化
(7)温度和体积一定时,容器内压强不再变化
(8)条件一定,混合气体的平均相对分子质量不再变化
(9)温度和体积一定时,混合气体的颜色不再发生变化
(10)温度和压强一定时,混合气体的密度不再发生变化
参考答案:(2)(6)(9)
本题解析:判断可逆反应是否已达平衡状态,关键是紧紧围绕这着“等”[υ(正)=υ(逆)]与“定”(条件一定,反应混合物的含量保持不变)这两个因素来判断。而“定”并非是指反应混合物的含量“相等”或者“成比例”。特别反应2HI H2+I2(g)的气体的计量数前后不变。(1)虽然表示的是不同的反应方向,但不能证明υ(正)=υ(逆),故不正确;(2)能表示υ(正)=υ(逆),则此项正确;(3)、(5)是浓度相等或成比例,并不能说明“定”的真正含义,故不正确;(4)速率之比虽然正确,但未指明正逆速率的关系,故不正确;(6)条件一定,某一生成物浓度不再变化,说明了“定”的真正含义,故正确;(7)对于反应2HI(g)
H2+I2(g)的气体的计量数前后不变。(1)虽然表示的是不同的反应方向,但不能证明υ(正)=υ(逆),故不正确;(2)能表示υ(正)=υ(逆),则此项正确;(3)、(5)是浓度相等或成比例,并不能说明“定”的真正含义,故不正确;(4)速率之比虽然正确,但未指明正逆速率的关系,故不正确;(6)条件一定,某一生成物浓度不再变化,说明了“定”的真正含义,故正确;(7)对于反应2HI(g) H2(g)+I2(g),前后气体体积不变,当温度、体积一定时,压强不变不能说明反应已达平衡状态;而对于反应2NO2
H2(g)+I2(g),前后气体体积不变,当温度、体积一定时,压强不变不能说明反应已达平衡状态;而对于反应2NO2 N2O4;前后气体体积不相等,当温度、体积一定时,压强不变能说明任何物质的物质的量不变,为“定”值,故反应已达平衡状态;(8)对于反应2HI(g)
N2O4;前后气体体积不相等,当温度、体积一定时,压强不变能说明任何物质的物质的量不变,为“定”值,故反应已达平衡状态;(8)对于反应2HI(g) H2(g)+I2(g),前后气体物质的量不变,质量不变,混合气体的平均相对分子质量不再变化不能说明反应已达平衡;而对于反应2NO2
H2(g)+I2(g),前后气体物质的量不变,质量不变,混合气体的平均相对分子质量不再变化不能说明反应已达平衡;而对于反应2NO2 N2O4,前后气体物质的量不相等,质量不变,混合气体的平均相对分子质量不再变化能说明任何物质的物质的量不变,为“定”值,故反应已达平衡;(9)混合气体的颜色不再发生变化,说明各物质的浓度不变,证明反应已达平衡状态;(10)对于反应2HI(g)
N2O4,前后气体物质的量不相等,质量不变,混合气体的平均相对分子质量不再变化能说明任何物质的物质的量不变,为“定”值,故反应已达平衡;(9)混合气体的颜色不再发生变化,说明各物质的浓度不变,证明反应已达平衡状态;(10)对于反应2HI(g) H2(g)+I2(g);前后气体物质的量不变,当温度、压强一定时,体积不变,密度不变,不能说明反应已达平衡状态;而对于反应2NO2
H2(g)+I2(g);前后气体物质的量不变,当温度、压强一定时,体积不变,密度不变,不能说明反应已达平衡状态;而对于反应2NO2 N2O4,前后气体物质的量不相等,当温度、压强一定时,体积不变,密度不变,能说明反应已达平衡状态。
N2O4,前后气体物质的量不相等,当温度、压强一定时,体积不变,密度不变,能说明反应已达平衡状态。
本题难度:一般
4、选择题 工业上采用乙烯和水蒸气合成乙醇的原理为:CH2=CH2(g) + H2O(g)  CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( ?)
CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( ?)
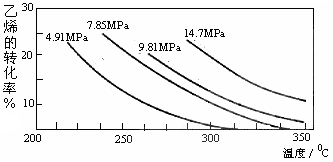
A.该反应为吸热反应
B.工业上采用7MPa左右,250~300℃,是综合考虑反应速率和乙醇的产率等因素的结果
C.相同温度下,压强越大,乙烯的转化率越大,平衡常数越大
D.给予足够的压强和适当的温度,可实现乙烯的转化率为 100%
参考答案:B
本题解析:A、温度升高、转化率降低,平衡逆向移动,逆向吸热,正向放热;B、正确;C、平衡常数只与温度有关,相同温度下,为定值;D、该反应为可逆反应,有一定限度,转化率不可能为100%。
本题难度:一般
5、选择题 在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:A(g)+2B(g)?C(g)+D(g)已达到平衡状态( )
①混合气体的压强②混合气体的密度③各气体物质的物质量浓度④气体的总物质的量⑤混合气体的平均相对分子质量.
A.②③⑤
B.①②③
C.②③④⑤
D.①③④⑤
参考答案:①反应前后气体的化学计量数之和不相等,当达到平衡状态时,压强不变,故正确;
②反应前后气体的质量不变,容器的体积不变,所以无论反应是否达到平衡状态,混合气体的密度始终不变,故错误;
③当反应达到平衡状态时,各物质的物质的量浓度不变,故正确;
④反应前后气体的物质的量之和不相等,当达到平衡状态时,气体的总物质的量不变,故正确;
⑤反应前后气体的质量不变,但混合气体的物质的量改变,当反应达到平衡状态时,混合气体的物质的量不变,则混合气体的平均相对分子质量不变,故正确,
故选D.
本题解析:
本题难度:一般