微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是 ( )
①活化分子间的碰撞一定能发生化学反应
②普通分子有时也能发生有效碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应实质是活化分子有合适取向时的有效碰撞
A.③④⑥
B.①②⑤
C.③④⑤⑥
D.②③④
参考答案:A
本题解析:活化分子间的碰撞不一定能发生化学反应,①错误;只有活化分子才能发生有效碰撞,②错误;使用催化剂能提高反应速率,原因是催化剂可以降低反应的活化能,使有效碰撞频率增大,⑤错误,其余选项都是正确的,答案选A。
点评:该题是中等难度试题的考查,侧重考查学生对活化分子、有效碰撞等有关概念的熟悉了解程度,以及灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:简单
2、选择题 可逆反应2SO2+O2?2SO3在恒温恒容下进行,能说明反应达到平衡的是( )
A.单位时间内消耗nmolSO2,同时生成nmolSO3
B.v逆(SO3)=2v正(O2)
C.容器内气体的密度保持不变
D.v(SO2)=v(SO3)
参考答案:A、单位时间内消耗n molSO2,同时生成n molSO3,表示的是正逆反应速率,但是不满足二者的化学计量数关系,说明正逆反应速率不相等,没有达到平衡状态,故A错误;
B、v逆(SO3)=2v正(O2),正逆反应速率相等,该反应达到了平衡状态,故B正确;
C、容器容积不变,气体的体积不变,反应两边都是气体,气体的总质量不变,根据ρ=mV,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故C错误;
D、v(SO2)=v(SO3),二者化学计量数相等,反应速率始终相等,无法判断正逆反应速率是否相等,故D错误;
故选B.
本题解析:
本题难度:一般
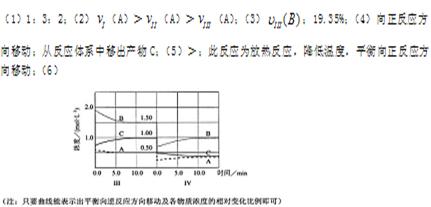
3、填空题 (12分)反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a:b:c为?;
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为?;
(3) B的平衡转化率aI(B)、aII(B)、aIII(B)中最小的是?,其值是?;
(4)由第一次平衡到第二次平衡,平衡移动的方向是?,采取的措施是?;
(5)比较第II阶段反应温度(T1)和第III阶段反应速度(T3)的高低:T2?T3
填“>、=、<”判断的理由是?;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
参考答案:A
本题解析:略
本题难度:简单
4、选择题 已知:4NH3 (g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-1025 kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g)ΔH=-1025 kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
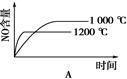 ?
?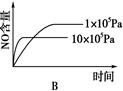 ?
?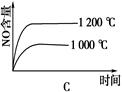 ?
?
参考答案:C
本题解析:根据反应式可知,该反应是体积增大的放热的可逆反应。所以减小压强或降低温度平衡都向正反应方向移动,NO的含量增大,但反应速率均是降低,据此可知,选项C不符合题意,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练。该题的关键是理解并能灵活运用勒夏特列原理,任何再结合图像和具体的反应式灵活运用即可,有利于培养学生的逻辑推理能力。
本题难度:简单
5、选择题 一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志是( )
A.N2,H2和NH3的质量分数不再改变
B.c(N2):c(H2):c(NH3)=1:3:2
C.某时间内断裂3molH-H键的同时,形成6molN-H键
D.单位时间里每增加1molN2,同时减少2molNH3
参考答案:A、N2、H2和NH3的质量分数不再改变,说明达到平衡状态,故A正确.
B、平衡时各物质的浓度取决于反应开始时的配料比以及反应转化的程度,不能用来判断是否达到平衡状态,故B错误;
C、无论反应是否达到平衡状态,只要断裂3molH-H键的同时,就形成6molN-H键,所以不能用来判断该反应达到平衡状态,故C错误.
D、无论反应是否达到平衡状态,只要单位时间里每增加1molN2,同时减少2molNH3,所以不能用来判断该反应达到平衡状态,故D错误.
故选A.
本题解析:
本题难度:简单