微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列递变规律正确的是
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr 、HI的稳定性依次增强
C.钠、镁、铝的金属性依次减弱
D.N、O、F原子半径逐渐增大
参考答案:C
本题解析:同周期,由右向左,原子的得电子能力逐渐减弱,则最高价氧化物对应水化物的酸性逐渐减弱,故A错误;
同主族,由上到下,原子的得电子能力逐渐减弱,则气态氢化物的稳定性依次减弱,故B错误;
同周期,由左到右,原子的失电子能力逐渐减弱,则元素的金属性逐渐减弱,故C正确;
同周期,由左到右,原子半径逐渐减小,故D错误;
本题难度:简单
2、填空题 (14分)现有6种短周期元素的性质或原子结构如下表:
元素编号
| 元素性质或原子结构
|
W
| 周期表中原子半径最小的元素
|
U
| 地壳中含量最多的金属元素
|
R
| 单质为空气的主要成分
|
T
| M层上有6个电子
|
X
| 最外层电子数是次外层电子数的2倍
|
Y
| 氢化物水溶液呈碱性
|
Z
| 元素最高正价是+7价
|
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有?个电子;元素X的一种核素可测定文物年代,这种核素的
符号是?。
(2)用电子式表示:
①气态化合物XR2_________________;
②元素W、R形成的10电子分子的形成过程______________________________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应? _____;
②元素U的单质与NaOH溶液反应_______________________________________。
(4)元素Z与元素T相比,非金属性较强的是?,下列表述中能证明这一事实的
是?(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价
氧化物的水化物中,化学性质明显不同于其他三种的是??(用分子式表示),
理由是?。
参考答案:(2、3小题各4分,其余每小题2分)
(1)16? ?
?
(2)
(3)NH4+ + OH- NH3↑+H2O? 2Al + 2OH- + 2H2O ="2" AlO2-+ 3H2↑
NH3↑+H2O? 2Al + 2OH- + 2H2O ="2" AlO2-+ 3H2↑
(4)Cl? b?(5)H2CO3? H2CO3是弱酸性(或非氧化性酸)
本题解析:略
本题难度:简单
3、选择题 已知铱(Ir)元素的一种同位素是 ,则其核内的中子数是
,则其核内的中子数是
A.77
B.114
C.191
D.268
参考答案:B
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此可知该核素的质子数=77,质量数=191。又因为质子数+中子数=质量数,所以该核素的中子数是191-77=114,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:简单
4、填空题 2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。砷化镓的晶胞结构如图。试回答:
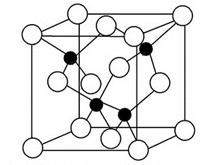
(1)镓的基态原子的电子排布式是_______。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为______,与同一个镓原子相连的砷原子构成的空间构型为______。
(3)下列说法正确的是_________(填字母)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As<Ga
C.电负性:As>Ga
D.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是_________。
(5)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为________。
参考答案:(8分)(1)1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
(2)4?正四面体? (3)C、D
(4)NH3>AsH3>PH3
(5)sp2
本题解析:(1)镓位于周期表中第四周期第IIIA,故其核外电子排布式为1s22s22p63d104s24p1或[Ar]3d104s24p1,故答案为:1s22s22p63d104s24p1。
(2)根据“均摊法”:白色球个数为6×(1/2) +8×(1/8)=4.由晶胞图可知与同一个镓原子相连的砷原子构成的空间构型为正四面体,故答案为:4;正四面体。
(3)A.NaCl晶体中阴阳离子的配位数为6,而砷化镓晶胞中中阴阳离子的配位数为8,二者晶体结构不同,故A错误;
B.As和Ga处于同一周期,而处于VA的As外围电子处于半满的较稳定结构,故As的第一电离能大于Ga,故B错误;
C.周期表同周期元素从左到右元素的电负性逐渐增大,则As>Ga,故C正确;
D.根据等电子体的概念可知二者价电子数相等,属于等电子体,故D正确;
故答案为:CD.。
(4)由于NH3分子间存在氢键,所以NH3的沸点最高,由于AsH3的相对分子质量大于PH3,故AsH3的沸点高于PH3,
故答案为:NH3>AsH3>PH3;
(5)由于Ga原子周围只有3对成键电子对,故其杂化方法为sp2,故答案为:sp2。
点评:本题以第三代半导体砷化镓为背景,全面考查原子结构与性质、分子结构及晶体结构知识灵活掌握程度,另一方面通过LED推广使用形成节能减排价值取向和环境友好的消费情趣.这类试题常常是通过小背景作为生长点,融合物质的结构与性质大部分知识内容。
本题难度:一般
5、选择题 短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是?
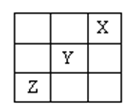
A.X原子最外层电子数最多
B.Y的非金属性比X的非金属性强
C.Z的最高价氧化物的水化物是强碱
D.Z的原子半径大于Y的原子半径
参考答案:D
本题解析:知周期中符合如图所示的位置即X为He、Y为F、Z为S;
A错,Y即F元素原子最外层电子数最多有7个;B错,X为稀有气体,不存在非金属性、金属性;C错,Z的最高价氧化物的水化物为硫酸,是强酸;D正确,Z即为S原子,有三个电子层,而Y即F只有两个电子层且F为非金属性最强的一种元素,所以Z的原子半径大于Y的原子半径。
本题难度:简单