微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:
。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。
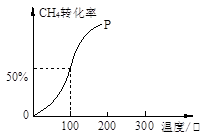
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A c(H2)减少 B 正反应速率加快,逆反应速率减慢
C CH3OH 的物质的量增加 D 重新平衡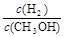 减小
减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
参考答案:(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1(2分)
(2)①0.03 mol?L-1?min-1(2分)②2.25×10-4(2分)
(3)C、D(各1分,共2分)
(4)①Co2+—e-=Co3+(2分)
②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+(2分)
本题解析:(1)I:CH4(g)+H2O (g)="CO" (g)+3H2(g)△H=+206.0kJ?mol-1
II:CO(g)+2H2(g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4(g)+H2O (g)="CO" (g)+3H2(g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率="1.5mol÷100L÷5min=0.03" mol?L-1?min-1。
②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K=0.005×0.0153÷(0.005×0.015)=2.25×10-4。
(3)A.平衡后将容器的容积压缩到原来的1/2,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡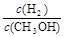 减小,故D正确;E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误。
减小,故D正确;E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误。
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+。
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:本题考查热化学方程式、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池。
本题难度:困难
2、推断题 烯烃通过臭氧化并经锌和水处理得到醛或酮。例如:
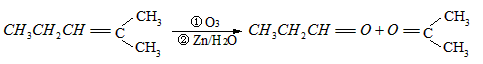
I. 已知丙醛的燃烧热为1815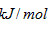 ,丙酮的燃烧热为1789
,丙酮的燃烧热为1789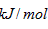 ,试写出丙醛燃烧的热化学方程式_____________ 。
,试写出丙醛燃烧的热化学方程式_____________ 。
II. 上述反应可用来推断烯烃的结构。一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。反应图示如下:
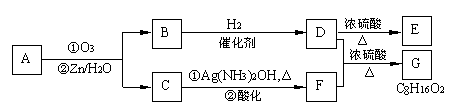
回答下列问题:
(1)B的相对分子质量是________;CF的反应类型为________;D中含有官能团的名称 __________。
(2)的化学方程式是:_______________ 。
(3)A的结构简式为 _______________。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理只得到一种产物,符合该条件的异构体的结构简式有___________ 种。
参考答案:I.
II. (1)86; 氧化反应 ;羟基
(2)
(3)
(4)3
本题解析:
本题难度:一般
3、填空题 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
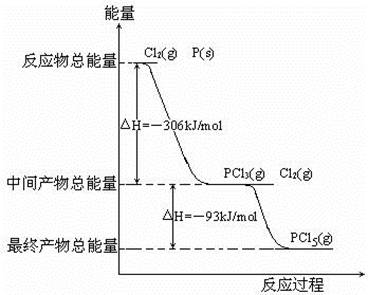
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H3= ;P和Cl2一步反应生成1mol PCl5的△H4 △H3 (填“大于”、“小于”或“等于”),原因是 。
参考答案:(1)2P(s)+3Cl2(g)=2PCl3(g) △H =-612kJ/mol(2分)
(2)PCl5(g)=PCl3(g)+Cl2(g) △H =+93kJ/mol(2分) 25%(2分) 大于(2分)
(3)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成(2分)
(4)-399kJ/mol (2分) 等于(1分),根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的(2分)
本题解析:(1)首先写出化学方程式并注明状态,然后根据图中的△H表示生成1mol产物的数据,可求出?H=2×-306kJ?mol?1=-612kJ?mol?1,进而写出热化学方程式。
(2)PCl5分解生成PCl3和Cl2为图中反应的逆反应,?H为相反数,为+93kJ?mol?1;加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,说明反应了0.2molPCl5,则分解率α1=0.2mol÷0.8mol×100%=25%;因为PCl5分解为吸热反应,温度升高,PCl5的分解率增大,故α2大于α1。
(3)温度过高,会促进PCl5的分解,不利于生成PCl5。
(4)根据图示可求出P和Cl2分两步反应生成1mol PCl5的△H3= —306kJ?mol?1—93kJ?mol?1=-399kJ?mol?1;根据盖斯定律,对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,所以?H3=?H4。
考点:本题考查热化学方程式的书写、盖斯定律、分解率的计算及温度对化学平衡的影响。
本题难度:困难
4、填空题 (1)环境专家认为可以用铝将水中的NO3
参考答案:
本题解析:
本题难度:困难
5、填空题 (14分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示。
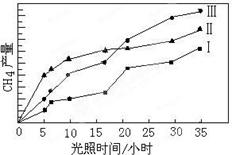
(1)在0-30小时内,CH4的平均生成速率vⅠ、vⅡ和vⅢ从大到小的顺序为 ;
反应开始后的12小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802kJ?mol-1
写出由CO2生成CO的热化学方程式
参考答案:(1)VⅢ>VⅡ> VⅠ;Ⅱ。 (2)三步计算可求CH4的转化率为:0.1/0.11=0.91
(3)CO2(g) +3H2O(g) =2O2(g) +CO(g)+3H2(g) △H="+1008" kJ?mol-1
本题解析:(1)由图像可以看出,反应进行到30小时时,催化剂Ⅲ生成的甲烷最多,其次是催化剂Ⅱ,催化剂Ⅰ生成的甲烷最少。因此VI、VII和VIII从大到小的顺序为VIII>VII>VI>;同理由图像也可以看出,反应进行到12小时时,催化剂Ⅱ生成的甲烷最多,因此在第Ⅱ种催化剂的作用下,收集的CH4最多。
(2)设CH4、H2O的物质的量均为xmol,则
CH4(g) + H2O(g)  CO(g) + 3H2(g)
CO(g) + 3H2(g)
起始量(mol) x x 0 0
变化量(mol) 0.10 0.10 0.10 0.30
平衡量(mol) x- 0.10 x- 0.10 0.10 0.30
根据题意,则平衡常数K=c(CO)·c3(H2)/[c(CH4)·c(H2O)]=(0.10mol·L-1)·(0.30mol·L-1)3/[(x-0.10)mol·L-1·(x- 0.10)mol·L-1]=27(mol·L-1)2,则x=0.11mol,所以CH4的转化率为0.1/0.11=0.91。
(3)由热化学方程式①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH="+206" kJ?mol-1②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802kJ?mol-1,①-②得CO2(g) +3H2O(g) =2O2(g) +CO(g)+3H2(g) △H="+1008" kJ?mol-1。
CO(g)+3H2(g) ΔH="+206" kJ?mol-1②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802kJ?mol-1,①-②得CO2(g) +3H2O(g) =2O2(g) +CO(g)+3H2(g) △H="+1008" kJ?mol-1。
考点:本题考查化学反应速率的概念、计算及外界条件对反应速率对影响;反应热的概念和盖斯定律的计算;与化学平衡有关的计算。
点评:本题综合性强,是高考中的热点考题,主要考查学生的分析问题,解决问题的能力。
本题难度:困难