微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)1molO2与足量氢气反应产生水蒸气放热483.6kJ,若1g水蒸气转化成液态水放热2.444kJ,请写出表示氢气燃烧热的热化学方程式:______.
(2)由汽油裂解得到乙烯、丙烯是重要的化工原料,请写出下列转化的方程式,并注明反应类型.
丙烯→聚丙烯______
(3)将N2、H2置于容积为2L的密闭容器中,发生反应,反应进行到4S末,测得N22mol、H21.5mol、NH32mol.则用氮气浓度的减少来表示该反应速率为______.
(4)在500ml密闭容器中,将2molA和1molB混合加热到500℃,达到平衡2A(g)+B(g)?3C(g)K=16求A转化为C的转化率为______.
(5)在密闭容器中发生下列反应:aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则a______c+d(填“>”、“=”或“<”).
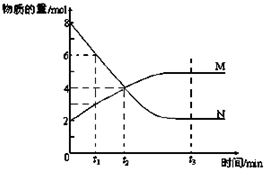
(6)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,反应的化学方程式为______.
2、选择题 下列说法正确的是
[? ]
A.等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多
B.植物通过光合作用将二氧化碳转化为葡萄糖是太阳能转化为热能的过程
C.在101kPa时,1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热
D.热化学方程式中的△H的值与反应物的用量有关
3、填空题 (12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
4、选择题 已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H= -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H= -b kJ/mol
若a、b均大于零,则a和b的关系为
A.a<b
B.a=b
C.a>b
D.无法确定