微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:

已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na 2S2O3+I2 = + 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式 。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是 。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至 (填“酸性” 或“中性”或“碱性”),原因是 。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为 ____kg(计算结果保留3位有效数字)。
参考答案:(1) Na2S4O6 (2分)
(2)2CuI(s)+S2—=Cu2S(s)+2I— (3分)
(3)减少氧化过程中生成的氮的氧化物的污染 (2分)
(4)中性 (2分)Ca(IO3)2在硝酸溶液中溶解,故要中和过量的酸;在碱性溶液中,会混有微溶的Ca(OH)2造成产品不纯。 (2分)
(5)3H2O+I— -6e—=IO3—+6H+ (3分) ; 1.20(2分)
本题解析: (1)该过程称之为还原过程,可以肯定发生了氧化还原反应,所以根据方程式中的I的化合价降低可以知道,Na2S2O3 的中S的化合价升高,再根据Na、O原子守恒可以配平该方程式为2Na2S2O3+I2 = Na2S4O6+ 2NaI,还可以根据写出的化学方程式用电子得失配平验证。此处的难点关键在于缺项物质为中学阶段没接触过的连四硫酸钠,所以可能会出现想不到或是不敢写的情况,只要大胆利用所学的原则配平就可以了。
(2)还原过程中已经说明有沉淀CuI生成了,所以加入Na2S还会发生反应,则应该是通过已知条件中的沉淀溶解平衡常数进行比较得出结论,比较之下Cu2S比 CuI更加难溶,所以此时会发生沉淀转化,所以发生的反应方程式书写要按照沉淀溶解平衡的格式书写,方程式为2CuI(s)+S2—(aq)=Cu2S(s)+2I—(aq)。
(3)氧化步骤加入的H2O2 和浓硝酸起到氧化的目的,但是浓硝酸参与的反应容易产生氮氧化物污染环境,所以先加入过氧化氢。由于氧化性顺序HNO3>IO3—>H2O2 ,所以加入的过氧化氢只能把I-氧化为IO3- ,要使I2继续被氧化为IO3- ,还需要再加入浓硝酸,使浓硝酸反应更加完全,从而减少过程中氮氧化物的污染。
(4)加入石灰乳目的是反应得到Ca(IO3)2 ,且通过操作可以看出反应后要使Ca(IO3)2 尽可能多得以晶体形式析出,而Ca(IO3)2溶于硝酸,所以必须调节pH值把过量的硝酸中和掉,且加入的石灰乳不能过量,过量则会混入石灰乳沉淀杂质,所以应该调节pH至中性。
(5)用KI溶液电解制备Ca(IO3)2 溶液,则I-需要发生氧化反应在阳极放电生成IO3-,电解液是非碱性的,所以根据O原子守恒,IO3—中的O一定来源于H2O中,从而生成了H+,所以电极反应式为:3H2O+I— -6e—=IO3—+6H+ ;计算碘化钾的质量可以采用I原子守恒计算,所以有1/2n(KI)= n(Ca(IO3)2)=1000/166mol,m产品=M(Ca(IO3)2)×n(Ca(IO3)2)÷97.8%=390g/mol×1000/166mol÷97.8%≈1200g=1.20kg。
考点:本题考查的是化学工艺流程,涉及到了陌生的氧化还原反应缺项配平、沉淀转化、环境问题、PH调节、电化学基础、转化计算等内容。
本题难度:困难
2、选择题 下列说法中正确的是
[? ]
A.常温下,某溶液中由水电离的c(OH-)=1×10-13mol/L,则该溶液为NH4Cl溶液或NaOH溶液
B.25℃时,浓度均为1 mol/L的KHCO3和K2CO3溶液中,由水电离出来的c(OH-),前者大于后者
C.1 mL pH =1的H2SO4溶液与100 mL NaOH溶液混合后所得溶液的pH=7,则NaOH溶液的pH=11
D.25℃时pH=5的CH3COOH溶液和100℃时pH=5的AlCl3溶液中的c(H+)相等
参考答案:D
本题解析:
本题难度:一般
3、填空题 氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
(1)根据右下能量变化示意图:

写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1 K2(填“>”、“=”或“<”)
(3)下列各项能说明该反应达到平衡状态的是 (填字母序号)
a. v(H2)正="3" v(N2)逆
b. 容器内压强保持不变
c. 容器中混合气体的密度保持不变
d.: N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用下图实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红。
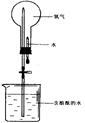
请回答:
①用化学用语说明所得氨水能使酚酞变红的原因 。
②250C时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为 (填字母序号)
a.c(Cl-)
参考答案:
本题解析:
本题难度:困难
4、选择题 从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( )
A.HR应为红色
B.HR应为蓝色
C.R-应为无色
D.R- 应为红色