微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在溴水中存在如下平衡:Br2+H2O
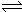
HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是( )
A.加压
B.加入NaOH
C.通入SO2气体
D.通入HCl气体
参考答案:BC
本题解析:
本题难度:简单
2、填空题 (16分)进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”。目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)气缸中生成NO的反应为:N2(g)+O2(g)=2NO(g) △H>0,汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。假设空气中N2和O2的体积比为4
参考答案:
本题解析:
本题难度:困难
3、选择题 某温度下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半
B.均加倍
C.均增加1mol
D.均减少1mol
参考答案:A、由于是在容积可变的容器中,则在“均减半”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故A、错误;
B、由于是在容积可变的容器中,则在“均加培”相当于A、B、C三物质的浓度都没有改变,平衡不会移动,故B错误;
C、同样由于容积可变,“均增加1mol”时相当于A、C物质的浓度减小,B物质的浓度增大,平衡向右移动,故C正确;
D、“均减小1mol”时相当于A、C物质的浓度增大,B物质的浓度减小,平衡向左移动,故D错误;
故选:C.
本题解析:
本题难度:简单
4、选择题 在容积不变的密闭容器中存在如下反应:2A(g)+B(g)  3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
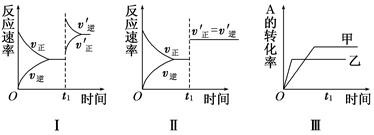
A.图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高