微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组反应中,第一个反应放出的热量比第二个反应放出的热量多的是(g、l、s分别表示气体、液体、固体)
A.
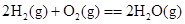
B.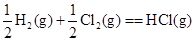

C.

D.
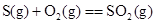
参考答案:A
本题解析:由于液态水的能量低于气态水的能量,所以氢气燃烧生成液态放出的热量多,A正确。B中参加反应的氢气越多,放出的热量越多。C中碳完全燃烧放出的热量多。D中固态S的能量低于气态S的能量,因此气态S燃烧放出的热量多,答案选A。
点评:固态是高考中的常见题型,属于中等难度的试题。主要是考查学生对影响反应热大小的了解掌握程度,有利于培养学生的逻辑推理能力。该题的关键是明确反应热与与物质状态的关系,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 下列说法不正确的是
A.所有放热反应的发生都无需任何条件
B.化学变化中都伴有能量变化
C.电解水生成氢气和氧气时,电能转化为化学能
D.在一个确定的化学反应体系中,反应物的总能量可能高于生成物的总能量。
参考答案:A
本题解析:略
本题难度:简单
3、选择题 已知:H+ (aq)+OH- (aq)= H2O?△H1 =" -" 57.3 kJ·mol-1,
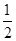 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)=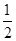 Na2SO4(aq)+ H2O(l)?△H2 = m,下列说法正确的是(?)
Na2SO4(aq)+ H2O(l)?△H2 = m,下列说法正确的是(?)
A.上述热化学方程式中的计量数表示分子个数
B.△H1>△H2
C.△H2 =" -" 57.3 kJ·mol-1
D.|△H1|>|△H2|
参考答案:B
本题解析:
【错解分析】此题旨在考查对“热化学方程式的意义”的理解和对“中和热”概念的掌握,属于容易题。
【正解】热化学方程式中的化学计量数表示物质的量,A项不对;浓H2SO4在稀释时放热,含0.5 mol H2SO4的浓H2SO4与1 mol NaOH反应放出的热量应等于浓硫酸稀释时放出的热量和中和热之和,因此,△H2 < △H1 < 0,且|△H1| > |△H2|。
本题难度:简单
4、选择题 下列说法中错误的是
A.测定中和热的实验中每次实验需要测定三次温度数据
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.凡经加热而发生的化学反应都是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热
参考答案:C
本题解析:
答案:C
C、不正确,加热只是为拆开反应物的化学键,反应吸热还是放热决定于拆开反应物的化学键所吸收的热量和形成生成物所放出热量的相对大小。
A、正确,多测几次,为了减小误差。
B、正确,反应吸热还是放热决定于拆开反应物的化学键所吸收的热量和形成生成物所放出热量的相对大小,化学键的断裂和形成是化学反应中能量变化的主要原因。
D、正确,从能量变化的角度,反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热。
本题难度:一般
5、选择题 下列有关叙述中,正确的是( )
A.需要加热才能发生的反应就一定是吸热反应
B.将Ba(OH)2?8H2O晶体与NH4Cl晶体混合、搅拌,会放出大量的热
C.在反应2CO+O2═2CO2中,反应物的总能量高于生成物的总能量
D.1mol?CaCO3固体完全分解会吸收178.5kJ的热量,其热化学方程式表示为:CaCO3═CaO+CO2 △H=+178.5kJ?mol-1
参考答案:A.反应条件与反应的吸热、放热无关,则需要加热才能发生的反应不一定是吸热反应,也可能为放热反应,故A错误;
B.Ba(OH)2?8H2O晶体与NH4Cl晶体混合,为吸热反应,不会放出热量,故B错误;
C.2CO+O2═2CO2为燃烧反应,属于放热反应,则反应物的总能量高于生成物的总能量,故C正确;
D.标注物质的状态,1molCaCO3固体完全分解会吸收178.5kJ的热量,其对应的△H=+178.5kJ/mol,则热化学反应方程式为CaCO3(s)═CaO(s)+CO2 (g)△H=+178.5kJ?mol-1,故D错误;
故选C.
本题解析:
本题难度:一般