微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
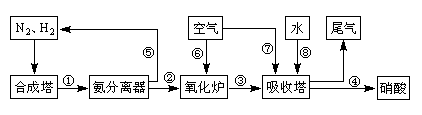
1、填空题 (16分)工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
T/℃
| T1
| 300
| T2
|
K
| 1.00×107
| 2.45×105
| 1.88×103
|
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
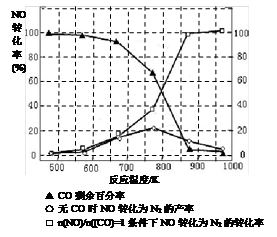
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
2、简答题 科学家要研究跟碳元素及其化合物相关的很多课题.
(1)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量,该反应的热化学方程式是______.
(2)工业上可用焦炭冶炼金属,若0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,则该反应的化学方程式是______.
(3)碳跟水蒸气制水煤气的反应是一个可逆反应,下列情况下能判断该反应一定达到平衡状态的是______(选填编号).
a.v正(H2O)=v正(H2) b.容器中温度不再发生改变
c.消耗n mol H2同时消耗n mol CO d.容器中气体的总物质的量不随时间改变
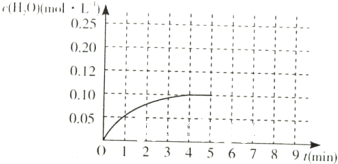
(4)温度T1时,在一体积为2L的密闭容积中,加入2.0mol CO和2.0mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应[C(s)+H2O(g)?CO(g)+H2(g)]的平衡常数的数值为______.在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在如图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示).
3、选择题 已知在298K时的有关数据:C(s)+1/2O2(g)===CO(g);ΔH1=-110.5kJ·mol-1;
C(s)+O2(g)===CO2(g);ΔH2=-393.5kJ·mol-1。则C(s)+CO2(g)===2CO(g)的ΔH为( )
A.+283.5kJ·mol-1
B.+172.5kJ·mol-1
C.-172.5kJ·mol-1
D.-504kJ·mol-1