微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业制硫酸的过程中利用反应2SO2(g)+O2(g)
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是______.
A.若反应速率v(SO2)﹦v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2molN2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.平衡后升高温度,平衡常数K增大
F.保持温度和容器体积不变,平衡后再充入2mol SO3,再次平衡时各组分浓度均比原平衡时的浓度大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min
SO2
O2
SO2
O2
1
T1
4
2
x
0.8
6
2
T2
4
2
0.4
y
9
|
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为______,表中y﹦______.
②T1______T2,(选填“>”、“<”或“=”),实验2中达平衡时O2的转化率为______.
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与c(OH-)之比为______.
②该溶液中c(OH-)=c(H+)+______+______(用溶液中所含微粒的浓度表示).
③当向该溶液中加入少量NaOH固体时,c(SO32-)______,水的离子积Kw______.(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是______.
A.Na2CO3B.Ba(NO3)2C.Na2SD.酸性KMnO4.
参考答案:(1)A、当正反应速率与逆反应速率相等,才能说明该可逆反应达到平衡状态,但反应速率v(SO2)﹦v(SO3),未强调反应方向,不能说明正逆反应速率相等,故A错误;
B、根据影响反应速率的影响因素,增加反应物的浓度,化学反应速率才能加快,但充入2molN2,对于该反应相当于惰性气体,反应物的浓度不变,反应速率不变,B错误;
C、平衡后仅增大反应物浓度,根据平衡移动原理,平衡一定右移,但各反应物的转化率不一定都增大,例如:增大SO2的浓度,O2的转化率增大,而SO2的转化率减小;C错误;
D、平衡后移动活塞压缩气体,即增大压强,根据平衡移动原理,平衡向正反应方向移动,所以,平衡时SO2、O2的百分含量减小,SO3的百分含量增大,D正确;
E、平衡常数K=c2(SO2)c(O2)c2(SO3),平衡后升高温度,平衡向吸热方向(逆反应)移动,SO2、O2的浓度增大,SO3的浓度减小,平衡常数K减小,E错误;
F、原平衡中充入2molSO2和1molO2,等效于充入2molSO3,保持温度和容器体积不变,平衡后再充入2mol SO3,即增大压强,平衡向正反应方向移动,生成物浓度比原平衡时的浓度大,压缩体积时,浓度已是原平衡的2倍,虽然平衡向正反应方向移动,但因为外界因素比平衡移动对平衡的影响更大,所以,反应物的浓度仍然增大.因此,再次平衡时各组分浓度均比原平衡时的浓度大,故F正确.
故选:DF.
(2)①由表中数据,v(O2)=2mol-0.8mol2L6min=0.1 mol?L-1?min-1
根据反应速率之比等于化学计量数之比,则v(SO2)=2v(O2)=0.2mol?L-1?min-1
实验2中,n(SO2)参加?(4-0.4)mol=3.6mol
n(O2)消耗=0.5n(SO2)=1.8mol
平衡时n(O2)=(2-1.8)mol=0.2mol
故答案为:0.2mol?L-1?min-1 ;0.2mol;
②平衡时,实验1中n(O2)=0.8mol 实验2中n(O2)=0.2mol,而开始时反应物的起始量相等,实验1到实验2的过程,相当于平衡向正反应方向移动,根据平衡移动原理,降温能使平衡向正反应方向移动,即T1>T2;
实验2中达平衡时 O2的转化率=n(O2)消耗÷n(O2)起始×100%=1.8mol÷2mol×100%=90%
故答案为:>;90%;
(3)∵pH=8
∴c(OH-)=10-14÷10-8=10-6mol?L-1而c(Na+)=2×c(Na2SO3)=2×0.1mol?L-1=0.2mol?L-1
∴c(Na+):c(OH-)=0.2mol?L-1÷10-6mol?L-1=2×105
故答案为:2×105;
②溶液中存在物料守恒:c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3),故答案为:c(HSO3-)+2c(H2SO3);
③Na2SO3溶液中存在水解平衡:SO32-+H2O?HSO3-+OH-根据水解平衡移动原理,加入少量NaOH固体,增大了c(OH-),平衡向逆方向移动,c(SO32-)增大水的离子积Kw只受温度影响,由于温度不变,所以Kw不变,
故答案为:增大;不变;
(4)假设溶液中溶质的物质的量为1mol,则
A中:Na2CO3+SO2=Na2SO3+CO2
1mol 1mol
B中:2Ba(NO3)2+3SO2+2H2O=3BaSO4↓+2NO+4HNO3(SO2溶于水后显酸性,酸性条件下会被NO3-氧化成SO42-,再和Ba2+生成沉淀)
1mol 1.5mol
C中:Na2S+2SO2+H2O=H2S+2NaHSO3
1mol 2mol
2H2S+SO2=3S+2H2O
1mol 0.5mol
所以1mol 的Na2S最终可吸收2.5molSO2
D中:2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
1mol 2.5mol
故答案为:B>C=D>A.
本题解析:
本题难度:一般
2、选择题 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)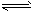 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
|

下列说法正确的是
[? ]
A.反应在t1min内的平均速率为ν(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
参考答案:BC
本题解析:
本题难度:一般
3、填空题 我国是第一产煤、用煤大国。但是,煤燃烧时会释放出大量的污染性或温室气体,如NOx、SO2、CO2等。如果对燃煤进行适当处理,既有利于实现绿色环保、节能减排的目标,又可达到变废为宝,节约资源的目的。
(1)利用甲烷催化还原NOx:
①CH4+4NO2=4NO+CO2+2H2O
②CH4+____NO=____+____CO2 +____H2O
请将反应②的化学方程式补充完整。
(2)利用NaOH溶液可吸收废气中的SO2。某火力发电厂每天排放的1. 12×104m3(标准状况下)尾气中含 0.2%(体积百分数)的SO2。则用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到石膏(CaSO4·2H2O)__________kg。
(3)将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H<0 在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。

①0~3min内,v(H2)=_______
②该条件下反应的平衡常数为________
③达到平衡时,气体条件不变的情况下增大压强,平衡常数______(填“增大”、“减小”或“不变”)。
参考答案:(1)4、2N2、1、2
(2)172
(3)①0.5 mol/(L·min);②5.33;③不变
本题解析:
本题难度:一般
4、选择题 2008北京奥运会前后,北京市政府出台了机动车单双号限行的措施,空气质量得到明显改善。已知NO和CO都是汽车尾气中的主要有害物质,它们能缓慢地反应生成N2和CO2:NO+CO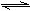 N2+CO2。有关该反应的下列叙述正确的是(?)?
N2+CO2。有关该反应的下列叙述正确的是(?)?
A.使用催化剂不能改变反应速率
B.降低压强有害物质转化的程度增大
C.改变压强对反应速率无影响
D.升高温度使反应速率加快
参考答案:D
本题解析:对于一个化学反应,通常都有加快其反应速率的催化剂;对于有气体参加的化学反应,压强会对反应速率造成影响;温度对任何化学反应的速率都会造成影响;该反应中反应前后气态物质分子总数不变,降低压强不影响平衡移动,也就不影响有害物质的转化程度。
本题难度:简单
5、选择题 2SO2(g)+O2(g)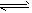 ?2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
?2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
[? ]
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强、反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO2(g)生成的平均速率为 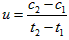
参考答案:D
本题解析:
本题难度:一般