|
高中化学知识点归纳《化学平衡》高频考点预测(2017年最新版)(十)
2017-09-25 18:07:52
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 9.下列事实不能用勒夏特列原理解释的是
A.热的纯碱去污效果更好
B.在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深
C.实验室可用排饱和食盐水的方法收集氯气
D.高压下有利于提高合成氨的产率
|
参考答案:B
本题解析:碳酸根水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,水解过程是吸热过程,升高温度促进碳酸根水解,碱性增强,去油污能力增强,能用勒夏特利原理解释;即使平衡不移动,压缩体积,颜色也会加深,所以B无法用勒夏特列原理解释;氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?HClO-+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可以勒夏特列原理解释;
考点:勒夏特列原理及应用
点评:勒夏特列原理在一个已经达到平衡的反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。
本题难度:一般
2、选择题 在盛有足量A的体积可变的密闭容器中通入B,发生反应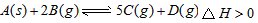 在一定温度、压强下达到平衡。平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法中正确的是 在一定温度、压强下达到平衡。平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法中正确的是
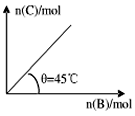
[? ]
A.平衡时B的转化率为60%
B.若再通入B,正逆反应速率均增大
C.在容器中加入少量A,则B的转化率增大
D.若保持压强一定,当温度升高时,图中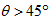
参考答案:D
本题解析:
本题难度:一般
3、填空题 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:______________________________。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH =-90.8 kJ·mol-1 CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)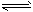 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)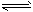 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)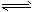 CH3OCH3(g) + CO2(g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。 CH3OCH3(g) + CO2(g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚?
(3)已知反应②2CH3OH(g)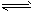 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
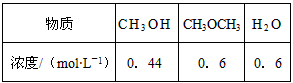
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 温度升高,该反应的平衡常数K ___________(填“增大”、“减小”或“不变”)
参考答案:(1)Na2CO3+H2S==NaHCO3+NaHS
(2)-246.4kJ· mol-1;a、 c、?e
(3) ① > ;② 减少
本题解析:
本题难度:一般
4、填空题 t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B(g)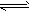 xC(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L, xC(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,
请填写下列空白:
(1)v(B) =_________,v(C) =_________,x=_________。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=_________;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
____________(填写字母序号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率保持不变
参考答案:(1)0.05 mol/(L·min);0.2 mol/(L·min);x=4
(2)2:1
(3)CD
本题解析:
本题难度:一般
5、填空题 (10分)两种气态单质X和Y能直接化合生成Z(可逆反应),如将X和Y按一定比例混合并压入密闭容器中,在不同温度下经过一段时间后,反应混合物中X的含量变化如下图所示,回答下列问题:
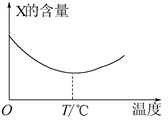
(1)上述X与Y化合生成Z的反应是__________反应(填“放热”或“吸热”);
(2)温度低于T℃时,反应混合物中X的含量 (填“逐渐增大”,“不变”,“逐渐减小”),原因是______________________________;温度高于T℃时,反应混合物中X的含量__________(填“逐渐增大”,“不变”,“逐渐减小”),原因是________________。
参考答案:.(1)放热
(2)逐渐减少 随着反应进行,反应物浓度逐渐减小
逐渐升高 升温,平衡向逆反应方向移动
本题解析:(1)X的含量最小时,说明反应达到平衡状态,再升高温度,X的含量增加,说明升高温度,平衡逆向移动,所以该反应是放热反应;
(2)根据图像可知,温度低于T℃时,反应混合物中X的含量逐渐减小,因为随反应的进行,反应物逐渐消耗,所以浓度逐渐减小;温度高于T℃时,反应混合物中X的含量逐渐增大,说明达平衡后升高温度,平衡逆向移动,X的浓度逐渐增大。
考点:考查对图像的分析,平衡的判断
本题难度:一般
|