微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (6分) 向1L AlCl3和FeCl3混合溶液中加入2mol /LNaOH溶液300mL时,产生的沉淀量达最大值;继续加入NaOH溶液,沉淀开始溶解,当加入NaOH溶液的总体积达到 350mL时,沉淀不再减少,求原溶液中FeCl3的物质的量浓度(需写出解题过程)。
参考答案:Al(OH)3 + NaOH = NaAlO2 + 2H2O
1mol?1mol
x? 2mol/L×(0.35L-0.3L)? x=0.1mol? (2分)
AlCl3 + 3NaOH = Al(OH)3 ↓+ 3NaCl
3mol? 1mol
y? 0.1mol? y=0.3mol? (2分)
FeCl3 + 3NaOH = Fe(OH)3 ↓+ 3NaCl
1mol? 3mol
z? (2mol/L×0.3L-0.3mol)? z=0.1mol
c(FeCl3)=0.1mol/1L=0.1mol/L? (2分)?答(略)
本题解析: 见答案
本题难度:一般
2、填空题 现有短周期元素A、B、C、D、E五种元素,原子序数依次增大,A是元素周期表中所有元素中原子半径最小的;B、C同周期且基态原子的最外层皆有2个未成对电子;D元素的简单离子是本周期元素的简单离子中半径最小的;E原子M层中p电子数比s电子数多2个。请按要求回答下列问题
(1)A和C组成的含有非极性键化合物的电子式为__________________。
(2)写出一种由上述元素组成,含极性键的非极性分子的化学式_______________
(3)写出E元素最高价氧化物对应水化物的化学式 ____________。
(4)写出D元素最高价氧化物对应水化物与NaOH溶液反应的离子方程式_____________________。
参考答案:(1)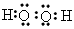
(2)CO2(CS2、CH4)
(3)H2SO4
(4)Al(OH)3+OH-=[Al(OH)4]-
本题解析:
本题难度:一般
3、选择题 将铝粉和某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等分。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L,另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为:
A.11.20L
B.15.68L
C.22.40L
D.31.36L
参考答案:A
本题解析:由于铁的氧化物中铁元素的化合价有+3价的,而铁和盐酸反应时,生成物是亚铁离子,所以根据电子的得失可知,铝热反应中产生的铁再和盐酸反应时生成的氢气要小于铝和氢氧化钠反应产生的氢气,所以答案选A。
本题难度:简单
4、计算题 有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
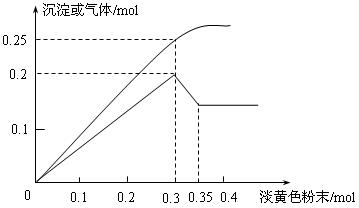
(1)淡黄色粉末为_____________(填名称),溶液中肯定没有____________离子。
(2)溶液中存在的各溶质阳离子的物质的量分别是_________________________。
(3)当加入0.3mol淡黄色粉末时,生成气体成分是?,?物质的量之比是?。
(4)①淡黄色粉末与水反应的化学方程式为__________________________。
②沉淀部分减少时的离子方程式为__________________________________。
参考答案:(1)(1分)过氧化钠?(2分) Fe3+、Cu2+
(2)(2分×3=6分)Mg2+︰0.1mol;NH4+︰0.1mol;Al3+︰0.1mol
(3)(2分×2=4分)NH3, O2?,2∶3?
(4)(2分×2=4分)
①2Na2O2+2H2O=4NaOH+O2↑? ②Al(OH)3+OH-= AlO2-+2H2O
本题解析:略
本题难度:简单
5、选择题 两份铝屑,第一份与盐酸反应,第二份与NaOH溶液反应,在相同状况下产生H2的体积比为1∶2,则第一份与第二份的质量比为(? )
A.1∶1
B.1∶2
C.1∶3
D.2∶1
参考答案:B
本题解析:据氧化还原反应中电子守恒知道,生成H2为1∶2,则两份铝失去的电子数也为1∶2,两份铝的质量也就为1∶2。
本题难度:简单