微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各装置中灵敏电流计指针会发生偏转的是( )
A.
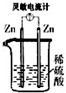
B.
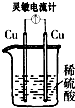
C.
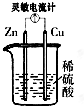
D.

参考答案:C
本题解析:
本题难度:一般
2、填空题 (12分)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ⊿H
CH3OH(g) ⊿H
已知某些化学键的键能数据如下表:
化学键
| C—C
| C—H
| H—H
| C—O
| C≡O
| H—O
|
键能/kJ·mol-1
| 348
| 413
| 436
| 358
| 1072
| 463
|
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的⊿H = ?;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min
| 0
| 5
| 10
| 15
| 20
| 25
|
压强/MPa
| 12.6
| 10.8
| 9.5
| 8.7
| 8.4
| 8.4
|
则从反应开始到20min时,以CO表示的平均反应速率=?,该温度下平衡常数K=?,若升高温度则K值?(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是?;
A、容器内气体的平均摩尔质量保持不变
B、2v(H2)正=v(CH3OH)逆
C、容器中气体的压强保持不变?
D、单位时间内生成nmolCO的同时生成2nmolH2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如右,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为?。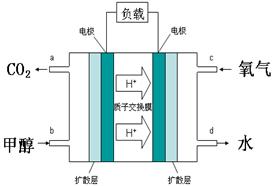
参考答案:(12分) (1) -116 kJ·mol-1?(2) 0.0125 mol·L-1·min-1 , 4 , 减小
(3)AC? (4) 2 CH3OH-12e-+2H2O=2CO2+12H+
本题解析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据反应式可知,该反应的△H=1072kJ·mol+2×436kJ·mol-3×412kJ·mol-358kJ·mol-463kJ·mol=-116kJ·mol.
(2)? CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始量(mol)? 1? 2? 0
转化量(mol)? x? 2x? x
平衡量(mol)? 1-x? 2-2x? x
所以有
解得x=0.5
CO表示的平均反应速率是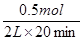 =0.0125 mol·L-1·min-1。该温度下平衡常数K=
=0.0125 mol·L-1·min-1。该温度下平衡常数K=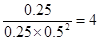 ;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以A可以说明;B中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不能说明;反应是体积减小的,所以压强也是减小的,C可以说明;D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,答案选AC。
(4)原电池中负极失去电子,所以甲醇在负极通入。由于质子交换膜只能允许氢离子通过,所以负极电极反应式是2 CH3OH-12e-+2H2O=2CO2+12H+。
本题难度:一般
3、选择题 钢铁发生吸氧腐蚀时,负极上发生的电极反应是(?)
A.2H+ + 2e- ="==" H2↑
B.Fe == Fe2+ + 2e-
C.2H2O + O2 + 4e- ="==" 4OH-
D.Fe3+ + e- ="==" Fe2+
参考答案:B
本题解析:钢铁中含有碳、铁,根据原电池工作原理,活泼的金属作负极,不如负极活泼的金属或导电的非金属作正极,所以碳作正极,铁作负极;负极失电子变成离子进入溶液,正极上得电子发生还原反应,钢铁发生吸氧腐蚀时,负极上发生的电极反应Fe? ==? Fe2+ + 2e-.
本题难度:简单
4、填空题 (7分)一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。。
(1)该电池反应的总离子方程式为____________________________________________;
(2)甲醇在_________极发生反应(填正或负),电池在放电过程中溶液的pH将__________(填降低或上升、不变);
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
②电池的正极反应式为____________________________________________?。
参考答案:(1)2CH3OH+3O2+4OH-=2CO32-+6H2O_(2分)
(2)?负(1分),?下降(1分)
(3)?负(1分), O2+4e-=2O2-(2分)。
本题解析:(1)负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式3/2O2+3H2O+6e-=6OH-,则总反应为2CH3OH+3O2+4OH-?=?2CO32-+6H2O;
(2)负极上燃料发生电极反应,甲醇在负极反应;放电时消耗氢氧根离子,pH降低。
(3)因为燃料被氧化,需要结果氧离子,所以氧离子向负极移动,正极氧气转化为氧离子,方程式为:O2+4e-=2O2-。
点评:本题以燃料电池为载体考查了原电池原理,根据电池反应式判断正负极上发生反应的物质及电极附近溶液PH值的变化即可解答本题,难度较大。
本题难度:一般
5、选择题 银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是
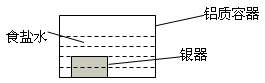
A.该处理过程中电能转化为化学能
B.银器为正极,Ag2S还原为单质银
C.Ag2S溶解于食盐水生成了AgCl
D.铝质容器为阳极,其质量变轻
参考答案:B
本题解析:A该处理过程是构成了原电池装置,是把化学能转化为电能,AD都错误;B.由于铝比较活泼,做负极,银器为正极,Ag2S还原为单质银,正确;C.Ag2S在食盐水中溶解,错误;
本题难度:一般