微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1 mol·L-1 500 mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
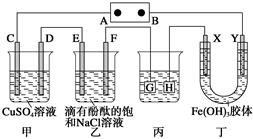
(1)若甲、乙装置中的各电极均只有一种单质生成时,对应各单质的物质的量之比为(按图中从左到右的顺序)_____________。
(2)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时,丙中镀件上析出银的质量为________,甲中溶液的pH是________。
(3)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是________。
(4)丁中X、Y两极附近的颜色变化情况是_________,产生这种现象的原因是________。
参考答案:(1)1∶2∶2∶2(2分) (2)镀件;AgNO3;5.4 g;1(各1分)
(3)Fe+Cu2+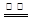 Cu+Fe2+(2分)
Cu+Fe2+(2分)
(4)X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深;
氢氧化铁胶体粒子带正电荷在电场作用下向阴极移动(各1分)
本题解析: 将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;(1)C、D、E、F电极发生的电极反应分别为:4OH-
本题难度:一般
2、选择题 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
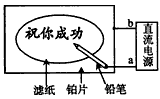
[? ]
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
参考答案:D
本题解析:
本题难度:一般
3、选择题 电极电解物质的量浓度相同的CuSO4和KCl的混合溶液一段时间后,测得溶液的pH<7。电解产物一定有下列物质:①Cl2②O2③Cu ④H2⑤KOH中的:( )?
A.①③
B.①②③
C.①②③④
D.①②④⑤
参考答案:B
本题解析:在阳极上,2Cl--2e-=Cl2↑,然后4OH--=2H2O+O2↑;阴极上发生,Cu2++2e-=Cu;2H++2e-=H2↑;因溶液呈酸性,故阳极上生成氯气和氧气,阴极上生成铜。
本题难度:一般
4、选择题 将质量分数为0.052的NaOH溶液1L(密度为1.06g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010时停止电解,则这时溶液中应符合的关系是
?
| NaOH的质量分数
| 阴极析出的物质的质量/g
| 阳极析出的物质的质量/g
|
A
| 0.062
| 19
| 152
|
B
| 0.062
| 152
| 19
|
C
| 0.042
| 1.2
| 9.4
|
D
| 0.042
| 9.4
| 1.2
参考答案:B
本题解析:本题考查考生对电解原理的理解。在设计试题时有意提供了某些可应用于速解的信息,借以考查考生思维的敏捷性。常规解:由题设条件可知,1LNaOH溶液中含有的溶质质量为:1000mL×1.06g·cm-3×0.052=55.12g,电解稀硫酸事实上消耗了水,使溶液浓度增大,停止电解时溶质的质量分数为0.062,停止电解时溶液的质量为: 。则被电解的水为:1060g-889g=171g。根据电解水的化学方程式不难算出:在阳极析出的氧气为: 。则被电解的水为:1060g-889g=171g。根据电解水的化学方程式不难算出:在阳极析出的氧气为: ,在阴极析出的氢气为: ,在阴极析出的氢气为: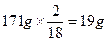 ,选项B正确;非常规解:根据电解NaOH溶液事实上是电解水这一结论,可看出随着电解的进行,溶液中溶质的质量分数增加,这样,C、D两项应予否定。电解水是阳极析出的是氧气,阴极析出的是氢气,它们的物质的量之比应为2︰1,前者质量大于后者,只有选项B符合题意。 ,选项B正确;非常规解:根据电解NaOH溶液事实上是电解水这一结论,可看出随着电解的进行,溶液中溶质的质量分数增加,这样,C、D两项应予否定。电解水是阳极析出的是氧气,阴极析出的是氢气,它们的物质的量之比应为2︰1,前者质量大于后者,只有选项B符合题意。
本题难度:一般
5、选择题 图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是 (?)?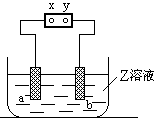 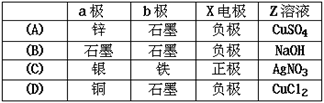
参考答案:A
本题解析:通电后发现a极板质量增加,所以金属阳离子在a极上得电子,a极是阴极,溶液中金属元素在金属活动性顺序表中处于氢元素后边;b极是阳极,b极板处有无色无臭气体放出,即溶液中氢氧根离子放电生成氧气,电极材料必须是不活泼的非金属,电解质溶液中的阴离子必须是氢氧根离子或含氧酸根离子.
A、该选项符合条件,故A正确.
B、电解质溶液中金属阳离子在氢元素前边,故B错误.
C、铁是活泼金属,作阳极失电子,所以在B极上得不到氧气,故C错误.
D、电解质溶液中氯离子失电子,在B极上得到有刺激性气味的气体,与题意不符,故D错误.
故选A.
本题难度:一般
|