微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)越来越多的食品问题所造成的危害有目共睹,给我们敲响了警钟。一些“毒奶粉”竟然顶着国家“免检产品”桂冠。某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7. 8倍,长期食用可能致癌。NaNO2有像食盐一样的咸味,能发生如下反应:
2NaNO2+4HI=2NO+I2+2NaI+2H2O。
(1)上述反应中氧化剂是______,若有1.75 mol的还原剂被氧化,则被还原的氧化剂是_______mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水、②碘化钾淀粉试纸、③淀粉、④白糖、⑤食醋、⑥白酒。进行实验时,必须选用的物质有________。(填编号)
(3)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂__________能使NaNO2转化为不引起二次污染的N2。(填编号)
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为____________________________________________。
参考答案:(1)NaNO2 1.75 (2)②⑤ (3)② NaNO2+NH4Cl=N2↑+NaCl+2H2O
本题解析:(1)在反应2NaNO2+4HI=2NO+I2+2NaI+2H2O中NaNO2中的N元素的化合价降低,获得电子,所以NaNO2是氧化剂;HI中的I元素的化合价升高,失去电子,被氧化,作还原剂;若有1.75 mol的还原剂被氧化,失去电子1.75 mol,根据氧化还原反应中电子转移数目相同可知:被还原的氧化剂是1.75mol;(2)若某物质是NaNO2,用碘化钾淀粉试纸和食醋在酸性下发生氧化还原反应产生碘单质遇淀粉变为蓝色;若是NaCl,就不会发生上述现象,因此选项物质是②⑤;(3) NaNO2有强氧化性,利用含有N元素的低价态的化合物NH4Cl发生归中反应就会转化为无污染的N2。选项是②,反应的方程式是NaNO2+NH4Cl=N2↑+NaCl+2H2O。
考点:考查氧化还原反应的概念、计算、物质的检验及化学方程式的书写的知识。
本题难度:一般
2、选择题 .下列化学用语错误的是
A.甲烷的电子式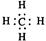
B.NH3的结构式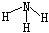
C.硫离子的核外电子排布式 1s22s22p63s23p4
D.碳-12可表示为126C
参考答案:C
本题解析:略
本题难度:一般
3、选择题 此反应:MnO2 +4 HCl(浓)  MnCl2 +Cl2↑+2H2 O,氧化剂和还原剂的物质的量比为
MnCl2 +Cl2↑+2H2 O,氧化剂和还原剂的物质的量比为
A.4∶1
B.1∶4
C.1∶1
D.1∶2
参考答案:D
本题解析:反应MnO2 +4 HCl(浓)  MnCl2 +Cl2↑+2H2 O中Mn元素的化合价从+4价降低到+2价,得到2个电子。氯元素的化合价从-1价升高到0价,失去1个电子,所以根据电子得失守恒可知,氧化剂和还原剂的物质的量比为1∶2,D正确,答案选D。
MnCl2 +Cl2↑+2H2 O中Mn元素的化合价从+4价降低到+2价,得到2个电子。氯元素的化合价从-1价升高到0价,失去1个电子,所以根据电子得失守恒可知,氧化剂和还原剂的物质的量比为1∶2,D正确,答案选D。
本题难度:一般
4、填空题 (9分)按要求写出方程式。
(1) 氢氧化铜溶于盐酸(写出离子方程式)?
(2)NaHSO4溶于水(写出电离方程式)?
(3)CO32— +2H+=CO2↑+H2O(写出对应的化学方程式)?(写出一个即可)
参考答案:(9分)(1)Cu(OH)2+2H+="=" Cu2+ + 2H2O
(2)NaHSO4="=" Na+ + H+ + SO42-
(3) Na2CO3 + 2HCl="=" 2NaCl + H2O +CO2↑
本题解析:略
本题难度:简单
5、选择题 将0.39g锌粉加入到20.0 mL的0.200 mol·L-1 MO2+溶液中,恰好完全反应,则还原产物可能是
A.M+
B.M2+
C.M3+
D.MO42-