微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)摩尔是表示______的单位,每摩尔物质均含有______个粒子.12g?12C中含有的碳原子数约为______个,1mol?H2O分子约含有______个电子,9g?H2O含有______mol电子.
(2)9.03×1023个氨分子含______mol氨分子,______mol氢原子.
(3)含有6.02×1023个OH-的Ba(OH)2的物质的量是______mol,质量______g.
参考答案:(1)摩尔是物质的量的单位;每摩尔物质均含有阿伏伽德罗常数个微粒;1mol规定为12g12C中含有的碳原子数;1mol H2O分子含有电子物质的量为10mol,电子数为6.02×1024;9g H2O物质的量=9g18g/mol=0.5mol;含电子物质的量为5mol;故答案为:物质的量;阿伏伽德罗常数;6.02×1023;6.02×1024;5;
(2)9.03×1023个氨分子含氨分子物质的量=n=NNA=9.03×10236.02×1023=1.5mol;含氢原子物质的量为4.5mol;故答案为:1.5mol;? 4.5mol;
(3)含有6.02×1023个OH-的物质的量为1mol,Ba(OH)2的物质的量为0.5mol;质量=0.5mol×171g/mol=85.5g;故答案为:0.5mol;85.5g;
本题解析:
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,1mol乙烯共用电子对数为4NA
B.1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA
C.标准状况下,1L戊烷充分燃烧后生成气态产物的分子数为5/22.4 NA
D.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 NA
参考答案:D
本题解析:乙烯的结构式为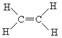 ,1mol乙烯共用电子对数为6NA,A错;
,1mol乙烯共用电子对数为6NA,A错;
乙醛与足量新制Cu(OH)2悬浊液反应的方程式为:CH3CHO + 2Cu(OH)2 + NaOH ="(Δ)" CH3COONa + Cu2O↓ + 3H2O,1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为2NA,B错;戊烷在标准状况下的状态为液态非气态,C错;乙烯的分子式为CH2=CH2,乙醇的分子式为C2H6O[可改写为C2H4(H2O)],所以0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 NA,D正确;
本题难度:一般
3、计算题 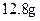 铜片与某浓度的硝酸反应,生成气体的体积在标准状况下为
铜片与某浓度的硝酸反应,生成气体的体积在标准状况下为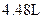 .
.  铜和硝酸反应的化学方程式为:
铜和硝酸反应的化学方程式为:
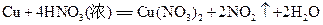
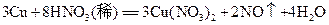
试计算:
(1)被还原的硝酸的物质的量
(2)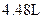 气体中各成分的物质的量
气体中各成分的物质的量
参考答案:(1) (
( 2)
2)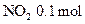 ,
,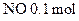 (各2分)
(各2分)
本题解析:略
本题难度:简单
4、选择题 设NA为阿伏加德罗常数的数值,下列说法正确的是
A.25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA
B.常温常压下, 14 g由N2与CO组成的混合气体含有的原子数目为NA
C.0.1L l mol·L-1Na2CO3溶液中,阴离子总数小于0.1NA
D.50ml、l8.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
参考答案:B
本题解析:A、不知道NaOH溶液体积,无法求算OH?的数目,错误;B、N2和CO的摩尔质量都是28g/mol,所以14 g由N2与CO组成的混合气体含有的原子数目为:14g÷28g/mol×2 NAmol-1=NA,正确;C、CO32?发生水解反应:CO32?+H2O=HCO3?+OH?,使阴离子数目增多,所以0.1L l mol·L-1Na2CO3溶液中,阴离子总数大于0.1NA,错误;D、随着反应的进行,硫酸的浓度逐渐减小,变为稀硫酸后与铜反应停止,所以生成SO2分子的数目小于0.46NA,错误。
本题难度:一般
5、选择题 摩尔是
[? ]
A.物质的量的单位
B.物质质量的单位
C.气体体积的单位
D.都不是
参考答案:A
本题解析:
试题分析:
解:A、物质的量的单位是摩尔,故A正确;
B、质量的单位是g,故B错误;
C、气体体积的单位是L或mL,故C错误;
D、显然不对;
故选A.
本题难度:简单