微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O。
则生成的盐溶液中NaNO2的物质的量为
A.0.4 mol
B.0.6 mol
C.0.8 mol
D.0.2 mol
参考答案:C
本题解析:反应中Cu-2e-—→Cu2+,NO—→NO、NO2、N2O4—→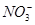 +
+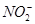 ,从电子守恒可知,铜失去的电子数与
,从电子守恒可知,铜失去的电子数与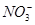 变成
变成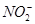 过程中得到的电子数相等,
过程中得到的电子数相等,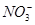 +2e-+2H+=
+2e-+2H+=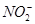 +H2O,故生成NaNO2的物质的量与铜的物质的量相等:
+H2O,故生成NaNO2的物质的量与铜的物质的量相等: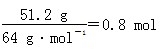 ,C项正确。
,C项正确。
本题难度:简单
2、计算题 实验室里用二氧化锰与浓盐酸反应 来制取适量的氯气。现用浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为11.2升,(假设HCl全部参加反应)
来制取适量的氯气。现用浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为11.2升,(假设HCl全部参加反应)
(M
 nO2+4HCl(浓)
nO2+4HCl(浓)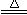 MnCl2+2H2O+Cl2↑)
MnCl2+2H2O+Cl2↑)
计算:(1)参加的二氧化锰的质量。?(2)被氧化的HCl的物质的量。
参考答案:24. 43.5g; 1mol
本题解析:略
本题难度:一般
3、填空题 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q 184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
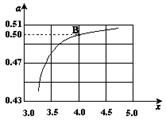
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)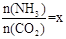 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
(3)图中的B点处,NH3的平衡转化率为 。
(4)已知: 3Cl2+2NH3→N2+6HCl
参考答案:
本题解析:
本题难度:困难
4、填空题 高锰酸钾和浓盐酸可以发生下列反应:
2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)该反应的氧化剂是___?___,还原剂是___?_____。
(2)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是________ mol。
参考答案:(1)KMnO4 HCl (2)1
本题解析:由方程式2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O可以知道,2KMnO4中的Mn的化合价有+7变为+2,Cl元素的化合价为-1变为0价,所以该反应的氧化剂是KMnO4,还原剂是HCl,该反应转移的电子数为5,所以若消耗0.2 mol氧化剂,即转移的电子数为1mol,所以被氧化的还原剂的物质的量是1mol。
点评:本题考查了一条氧化还原反应方程式的氧化剂和还原剂的判断以及相关的计算,是对氧化还原基础知识的考查,本题比较简单。
本题难度:一般
5、填空题 (1)5molCO2的质量是______;在标准状况下所占的体积约为______;所含的分子数目约为______;所含氧原子的数目约为______.
(2)12.4gNa2X中含有0.4molNa+,则Na2X的摩尔质量是______,X的相对原子质量是______,该物质的化学式为______.
(3)有下列7种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,请回答下列问题:
①将余下几种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
______+Na2SO3+______→Na2SO4+______+______+H2O
②反应物中发生氧化反应的物质是______(填化学式),被还原的元素是______.
参考答案:(1)m=nM=5mol×44g/mol=220g、V=nVm=5mol×22.4L/mol=112L、N=nNA=5mol×6.02×1023=3.01×1024(5NA)、氧原子数是分子数的2倍,即为6.02×1024?(10NA),
故答案为:220g;112L;3.01×1024(5NA);6.02×1024?(10NA);
(2)钠离子的物质的量是Na2X的2倍,所以Na2X的物质的量是0.2mol,据M=mn=12.4g0.2mol=62g/mol,物质的摩尔质量在数值上等于其相对分子质量,
X的相对原子质量=相对分子质量-2×23=16,所以为Na2O,故答案为:62g/mol;16;Na2O;
(3)①反应中亚硫酸钠中硫元素化合价升高,做还原剂,所以化合价能降低的KIO3来做氧化剂,对应的还原产物是单质碘,然后根据化合价升高和降低的数目相等来配平方程式,
故答案为:Na2SO3+KIO3+H2SO4→Na2SO4+I2+K2SO4+H2O;
②还原剂是Na2SO3,发生氧化感应,碘元素化合价降低,被还原,故答案为:Na2SO3;I.
本题解析:
本题难度:一般