微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O 91ExAm.org82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号
| 体积V/mL
|
K2S2O8溶液
| 水
| KI溶液
| Na2S2O3溶液
| 淀粉溶液
|
①
| 10.0
| 0.0
| 4.0
| 4.0
| 2.0
|
②
| 9.0
| 1.0
| 4.0
| 4.0
| 2.0
|
③
| 8.0
| Vx
| 4.0
| 4.0
| 2.0
|
表中Vx mL,理由是 。
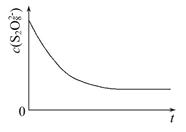
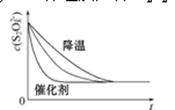
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s)ΔH
2LiI(s)ΔH
已知:①4Li(s)+O2(g) 2Li2O(s) ΔH1
2Li2O(s) ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
参考答案:(1) Na2S2O3 <2
(2)2.0 保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的;
(3)
(4)(△H1-△H2)/2 正
本题解析:(1)根据题目所给信息可知,若溶液中仍存在Na2S2O3,则碘单质将不会存在,溶液不会变蓝色,所以只有将Na2S2O3消耗完时,溶液才会由无色变为蓝色;根据化学方程式,Na2S2O3与K2S2O8完全反应,溶液中不存在碘单质时,Na2S2O3与K2S2O8的物质的量之比为2:1,所以为确保能观察到蓝色,则Na2S2O3的量少些,则n(S2O32-)∶n(S2O82-)<2;
(2)实验①、②中KI溶液、Na2S2O3溶液、淀粉溶液的体积不变,且K2S2O8溶液与水的总体积是10.0mL,该实验的目的是探究反应物浓度对化学反应速率的影响,为保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的,所以在实验③中K2S2O8溶液与水的总体积必须也是10.0mL,则Vx=2.0mL;
(3)降低温度,该反应的反应速率减慢,而使用催化剂则会加快反应速率,反应完全时溶液中c(S2O82-)不变,所以对应的图像为 ;
;
(4)在2Li(s)+I2(s) 2LiI(s)中I元素的化合价降低,发生还原反应,所以碘作电池的正极,根据盖斯定律可知,ΔH=(①-②)/2=(△H1-△H2)/2.
2LiI(s)中I元素的化合价降低,发生还原反应,所以碘作电池的正极,根据盖斯定律可知,ΔH=(①-②)/2=(△H1-△H2)/2.
考点:考查对实验现象的分析,化学反应速率与图像的关系,盖斯定律的应用
本题难度:困难
2、填空题 在恒定温度下反应NH2COONH4(s)  2NH3(g)+CO2(g)达到分解平衡:
2NH3(g)+CO2(g)达到分解平衡:
(1)可以判断该分解反应已经达到化学平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
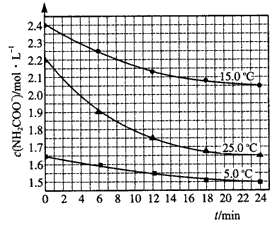
①计算25℃时,0~6min氨基甲酸铵水解反应的平均速率____________。
②根据图中信息,如何说明水解反应速率随温度升高而增大:______________。
参考答案:(1)BC
(2)①0.05 mol·L-1·min-1
②25℃反应物的起始浓度较小,但0~6 min的平均反应速率(曲线的斜率)仍比15℃大
本题解析:
本题难度:一般
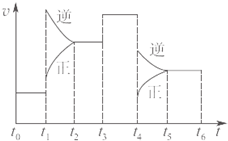
3、选择题 图为某化学反应速率一时间图。在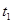 时刻升高温度或增大压强,都符合下图所示变化的反应是
时刻升高温度或增大压强,都符合下图所示变化的反应是

A.2SO2(g)+O2(g) 2SO3(g);ΔH<0
2SO3(g);ΔH<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0
4NO(g)+6H2O(g);ΔH<0
C.H2(g)+I2(g) 2HI(g); ΔH>0
2HI(g); ΔH>0
D.C(s)+H2O(g) CO(g)+H2(g) ;ΔH>0
CO(g)+H2(g) ;ΔH>0
参考答案:B
本题解析:由图可知:增大压强或升高温度,正反应、逆反应的速率都增大,但逆反应速率增大的多,化学平衡逆向移动。根据勒夏特列原理,增大压强,化学平衡向气体体积减小的方向移动。升高温度,化学平衡向吸热方向移动。即该反应的逆反应是气体体积减小的吸热反应。正反应是气体体积扩大的放热反应。A 正反应是气体体积减小的反应,错误。B正反应是气体体积扩大的放热反应。正确。C反应是等体积反应,错误。D正反应是吸热反应,错误。
本题难度:一般
4、选择题 在室温下,下列反应的反应速率最慢的是
[? ]
A.Ag++Cl-=AgCl
B.H+?+OH-=H2O
C.H2+F2=2HF
D.H2+Br2=2HBr
参考答案:D
本题解析:
本题难度:一般
5、选择题 一密闭容器中发生反应:2SO2(g)+O2(g)=2SO3(g)△H<0,如图表示该反应的速率(v)在某一时间内的变化.则下列时间段中,SO3的百分含量最高的是( )
A.t0→t1
B.t2→t3
C.t3→t4
D.t5→t6