微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是(? )
①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
A.①③④⑤
B.①②④⑤
C.①②③④
D.①②④
参考答案:B
本题解析:增大盐酸与锌粒的反应速率,可通过外界条件对化学反应速率的影响来考虑,可增大氢离子浓度、升高温度,增大固体的表面积或通过原电池反应等因素来实现。
①温度升高,反应速率增大,故①正确;②改用100mL3mol?L-1盐酸,反应物的浓度增大,反应速率增大,故②正确;③多用300mL 1mol/L盐酸,反应物的量增多,但浓度不变,反应速率不变,故③错误;④用等量锌粉代替锌粒,固体的表面积增大,反应速率增大,因此选项④正确;⑤滴入少量CuSO4溶液,锌可以置换出铜,从而构成铜锌原电池,加快反应速率,⑤正确,答案选B。
本题难度:一般
2、选择题 100毫升12?摩/升盐酸溶液与过量锌粉反应,在一定温度下,为了减慢反应进行的速度,但又不影响生成氢气的总量,可向反应物中加入适量的
①碳酸钙粉末?②氯化钠溶液?③氯化铵(固体)?④水( )
A.①、②
B.①、③
C.②、③
D.②、④
参考答案:①加入碳酸钙粉末,碳酸钙粉末与盐酸反应,降低溶液中H+离子的浓度,但H+离子的总物质的量减小,所以减慢反应进行的速度,但减少影响生成氢气的总量,故①错误;
②加入氯化钠溶液对盐酸进行稀释,降低溶液中H+离子的浓度,且H+离子的总物质的量不变,所以反应速率减慢,但不影响生成氢气的总量,故②正确;
③氯化铵水解溶液呈酸性,增大了溶液中H+离子的浓度,且H+离子的总物质的量增大,所以加快反应进行的速度,也增加影响生成氢气的总量,故③错误;
④加入水对盐酸进行稀释,降低溶液中H+离子的浓度,且H+离子的总物质的量不变,所以反应速率减慢,但不影响生成氢气的总量,故④正确;
故选:D.
本题解析:
本题难度:简单
3、选择题 在一定温度下的定容密闭容器中,下列说法能表明反应:A(s)+2B(g) 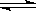 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的压强不变
B.消耗2molB的同时生成1molC
C.混合气体的相对分子质量不变
D.气体的总物质的量不变
参考答案:C
本题解析:反应前后体积不变,即气体的总物质的量不变,压强恒定。消耗2molB的同时一定生成1molC,所以不能说明。混合气体的相对分子质量是混合气的质量和混合气的物质的量的比值,物质的量不变,但质量是变化的,所以C可以说明。答案是C
本题难度:简单
4、填空题 某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20
4.0mol/L盐酸
少量气泡
较多气泡
大量气泡
反应剧烈
反应结束
2.0mol/L硫酸 | 无明显现象
极少量气泡 | 少量气泡
4.0mol/L硫酸
无明显现象 | 少量气泡 | 有比较连续的气泡
|
请回答:
(1)写出铝与盐酸反应的离子方程式______.
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是______.
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出你的假设(写出2种可能):______
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃).请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50.0mL、铝为9.0g过量):
| 实验目的 | 实验
编号 | 温度 | 金属铝
形态 | 盐酸浓度
/mol?L-1
|
1?实验①和②探究盐酸浓度对该反应速率的影响;
2实验①和③探究温度对该反应速率的影响;
3实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响.
①
25?C
铝片
4.0
②
③
④
参考答案:Ⅰ(1)离子方程式书写时,单质写化学式,易溶于水的强电解质写离子,故答案为:2Al+6H+=2Al3++3H2↑
(2)该反应是放热反应,随着反应的进行,放出的能量越多,溶液的温度升高,温度越高反应速率越快,
故答案为:反应放热使溶液温度升高,从而使化学反应速率加快
(3)盐酸和硫酸溶液中氢离子浓度相同,不同点是阴离子不同,
故答案为:1、Cl-能够促进金属铝与H+反应,或SO42-对H+与金属铝的反应起阻碍作用等.
(Ⅱ)(1)1、②根据题意知,①和②只有盐酸浓度不同,其它完全相同进行实验.
2、③根据题意,实验①和③只有温度不同,其它完全相同进行实验.
3、④根据题意,实验①和④只有金属规格不同,其它完全相同进行实验.
故答案为:
实验编号温度金属铝规格盐酸浓度/mol?L-1②25℃铝片2.0③35℃铝片4.0④25?C铝粉4.0
本题解析:
本题难度:一般
5、选择题 下列说法不正确的是:
A.能量较高、有可能发生有效碰撞的分子称为活化分子
B.活化分子的平均能量与所有分子的平均能量之差称为活化能
C.催化剂能参与反应,可降低原反应所需活化能
D.非活化分子也有可能发生有效碰撞
参考答案:D
本题解析:在相同温度下,分子的能量并不完全相同,有些分子的能量高于分子的平均能量,称为活化分子。能够发生有效碰撞的一定是活化分子,但是活化分子不一定发生有效碰撞。具有平均能量的分子变成为活化分子(处于活化状态B)所需要的能量,称为“活化能”,故D错。
本题难度:简单
|