微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,反应2SO2(g)+O2(g)  2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )。
2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )。
A.0.4 mol
B.0.6 mol
C.0.8 mol
D.1.2 mol
参考答案:A
本题解析:2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
起始/mol?2x?3x?4x
转化/mol?y? ?y
?y
平衡/mol?2x-y?3x- ?4x+y
?4x+y
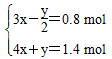
解得:x=0.3 mol,y=0.2 mol,所以2x-y=0.4 mol。
本题难度:一般
2、填空题 在一定温度和压强下,将N2和H2按1:3的体积比混合进入密闭容器内反应,达平衡后(温度,压强不变)氨占总体积的20%,则H2占总体积的____________。混合气体的平均相对分子质量为___________。
参考答案:60%? 10.2
本题解析:考查可逆反应的有关计算,一般采用三段式,即
N2+3H2 2NH3
2NH3
起始量(mol)? 1? 3? 0
转化量(mol)? x? 3x? 2x
平衡量(mol)?(1-x)(3-3x) 2x
所以有(1-x+3-3x+2x)×20%= 2x
解得x=1/3
因此氢气的体积分数是(3-3x)/(1-x+3-3x+2x)×100%=60%
混合气体的平均相对分子质量为(28+6)/(1-x+3-3x+2x)=10.2
本题难度:一般
3、填空题 I、如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2? ?N2O4 ΔH=-57 kJ/mol,
?N2O4 ΔH=-57 kJ/mol,

当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
(1)C中的气体颜色__________; (填“变浅”或“变深”)。
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=
0.0321mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
Ⅱ. 在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
① 推进针筒后颜色变深的原因是?;
②一段时间后气体颜色又变浅的原因是?
③?在此过程中,该反应的化学平衡常数将??(填“增大”、“减小”或“不变”,下同)NO2的转化率将?。
参考答案:I.(1)变浅?(2)0.0767 mol/L? 83.7%
Ⅱ.(1)①气体的体积减小,NO2浓度增大,气体的颜色加深
②增大压强,减小气体的体积,平衡向正反应方向移动?③不变?增大
本题解析:I.(1)硝酸铵溶于水吸热,且该反应的正反应是放热反应,所以C中平衡向正反应方向移动,颜色变浅。
(2)达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=0.032 1 mol/L,则消耗NO2的浓度是0.032 1 mol/L×2=0.0642 mol/L,所以NO2的起始浓度是0.012 5 mol/L+0.0642 mol/L=0.0767 mol/L。则NO2的转化率为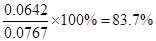 。
。
Ⅱ.(1)①气体的体积减小,因此NO2浓度增大,所以气体的颜色加深。
②增大压强,减小气体的体积,平衡向正反应方向移动,因此一段时间后气体颜色又变浅。
③平衡常数只与温度有关系,所以改变压强,平衡常数不变;平衡向正反应方向移动,所以反应物的转化率增大。
点评:该题是中等难度的试题,试题注重基础,侧重能力的考查和训练。该题有利于培养学生的逻辑思维能力和发散思维能力,有助于培养学生分析问题、解决问题的能力。
本题难度:一般
4、选择题 下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)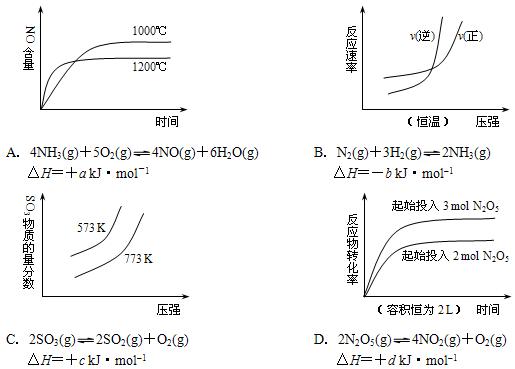
参考答案:C
本题解析:略
本题难度:一般
5、填空题 (16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g)? +? H2O(g),ΔH= +41.2 kJ/mol
反应②: 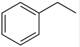 (g)→
(g)→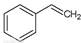 (g)+H2(g),ΔH=" +117.6" kJ/mol
(g)+H2(g),ΔH=" +117.6" kJ/mol
②的化学反应平衡常数分别为K1、K2。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式?。该反应的化学平衡常数K=?(用K1、K2表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是?。
A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小;
B.若继续加入1molCO2、1mol H2,平衡向正反应方向移动;
C.若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率增大;
D.压缩体积,平衡不移动,反应物和产物的浓度都不变;
