微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以提银后含锰废液中获得的碳酸锰、废硫酸及废铬铁催化剂等为原料生产二氧化锰、高铁酸钾及重铬酸钾,原料的综合利用率较高。其主要流程如下

(1)电解硫酸锰酸性溶液时,阳极的电极反应为:_________________________。
(2)反应IV中,每生成1molNa2CrO4消耗KClO3_________________mol。
(3)已知反应V是复分解反应。用离子反应方程式表示Na2CrO4溶液酸化时化学平衡的移动:_________________。
(4)反应VI的离子方程式为:__________________________________。
参考答案:(1)Mn2++2H2O-2e-=MnO2+4H+
(2)0. 5
(3)2CrO42-+2H+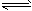 Cr2O72-+H2O
Cr2O72-+H2O
(4)3ClO-+2Fe(OH)3+4OH-=2FeO42-+3Cl-+5H2O
本题解析:
本题难度:一般
2、选择题 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn +2K2FeO4 +8H2O 3Zn(OH)2 +2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 +2Fe(OH)3 + 4KOH,下列叙述不正确的是
[? ]
A.放电时负极反应为:Zn - 2e- + 2OH- = Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- = FeO42- + 4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列有关电化学的图示,完全正确的是
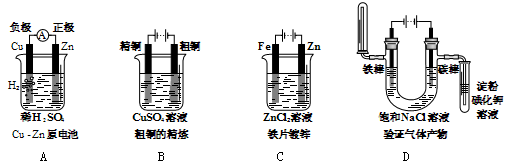
参考答案:D
本题解析:A.是原电池。由于金属活动性Zn>Cu,所以Zn作负极,Cu作正极。在正极上发生还原反应产生氢气,电极判断不对,错误;B.在铜的精炼中,精铜作阴极,粗铜作阳极,含有Cu2+的盐溶液如CuSO4溶液作电解质溶液,铜的连接不对,错误;C.该装置是电镀,在铁片上镀锌,应该把镀件Fe片作阴极,把Zn片作阳极,含有Zn2+的溶液作电镀溶液,金属片与电源的连接不对,错误;D.电解饱和NaCl溶液,在阳极发生反应:Cl--2e-=Cl2↑,Cl2有氧化性,会把KI中的I-氧化为I2,于淀粉溶液变为蓝色,在阴极发生反应:2H++2e-=H2↑,H2的密度比空气小,用向下排空气的方法收集。由于H+放电,破坏了水的电离平衡,水继续电离,最终当达到平衡时,附近的溶液c(OH-)>c(H+),溶液显碱性,
考点:考查原电池、电解池的反应原理及应用的知识。
本题难度:一般
4、选择题 MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
(l)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS +2H2SO4= MnSO4 +ZnSO4 +S↓+2H2O
(2)除去反应混合物中的不溶物
(3)电解混合液:MnSO4+ ZnSO4+2H2O MnO2+Zn+2H2SO4下列说法不正确的是
MnO2+Zn+2H2SO4下列说法不正确的是
[? ]
A.步骤(l)中MnO2和H2SO4都是氧化剂
B.步骤(1)中每析出12. 8 g S沉淀共转移0.8mol电子
C.步骤(3)中电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
参考答案:A
本题解析:
本题难度:一般
5、填空题 在25 ℃时,用石墨电极电解1000mL一定浓度的CuCl2溶液。5 min后电解完全,在一个石墨电极上只有1.28 g Cu生成。试回答下列问题:
(1)总反应式为?。
(2)电解过程中转移的电子数为?mol, 同时生成标准状况下气体的体积为?
(3) 该CuCl2溶液的物质的量浓度为?。
(4)有铜生成的是?(填“阳极”或“阴极”)
参考答案:(1)CuCl2 Cu+ Cl2 ↑?
Cu+ Cl2 ↑?
(2)0.04,? 0.448L
(3)0.02mol/L
(4)阴极
本题解析:电极电解CuCl2溶液,铜离子在阴极得到电子析出铜,氯离子在样极放电,生成了氯气,所以该反应式为CuCl2 Cu+ Cl2 ↑, 石墨电极上有1.28 g Cu生成,即生成了铜为0.02mol,转移的电子数为0.04mol,同时生成标准状况下气体的体积为0.04/2×22.4=0.448L;因为石墨电极上只生成了1.28 g Cu,所以该CuCl2溶液的物质的量浓度为0.02/1=0.02mol/L。
Cu+ Cl2 ↑, 石墨电极上有1.28 g Cu生成,即生成了铜为0.02mol,转移的电子数为0.04mol,同时生成标准状况下气体的体积为0.04/2×22.4=0.448L;因为石墨电极上只生成了1.28 g Cu,所以该CuCl2溶液的物质的量浓度为0.02/1=0.02mol/L。
点评:本题考查了电解池的相关知识,该题属于对基础知识的考查,只要熟悉相关考点,该题难度不大。
本题难度:一般