微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是

A.电源的M 极为正极
B.甲装置中溶液的pH 减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1
D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液
参考答案:C
本题解析:选项A,因Fe(OH)3胶粒带正电荷,W极附近颜色加深,说明W与电源负极相连,故M为电源的正极,N为电源的负极。选项B,电解CuSO4溶液时产生H2SO4导致溶液pH减小。选项C,根据反应:2CuSO4+ 2H2O 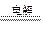 ?2Cu +O2↑+ 2H2SO4,X极上产生O2单质,Y极上产生Cu单质,二者物质的量之比为1:2。选项D,U为电镀池的阳极,Ag为阳极而溶解,AgNO3电镀液中的Ag+在R上析出而镀上Ag。
?2Cu +O2↑+ 2H2SO4,X极上产生O2单质,Y极上产生Cu单质,二者物质的量之比为1:2。选项D,U为电镀池的阳极,Ag为阳极而溶解,AgNO3电镀液中的Ag+在R上析出而镀上Ag。
本题难度:一般
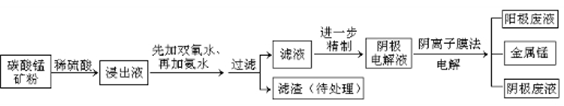
2、填空题 28(15分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
阴离子膜法电解装置如图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式 。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因 .
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
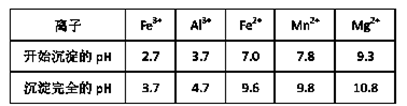
加氨水调节溶液的pH等于6,则滤渣的成分是 ,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是 极。实际生产中,以石墨为电极,阳极区以稀硫酸为电解液,阳极的电极反应式为 。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
参考答案:(1)MnCO3+2H+=Mn2++CO2↑+H2O
(2)MnO2在酸性条件下被二价铁还原为Mn2+
(3)Al(OH)3、Fe(OH)3;Mn2+、Mg2+、NH4+
(4)负极;4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+
(5)Mn2++2H2O-2e-=MnO2+4H+
本题解析:将碳酸锰矿粉溶于稀硫酸中,MnCO3、FeCO3、MgO、Al2O3都和稀硫酸反应生成硫酸盐,酸性条件下,MnO2被亚铁离子还原生成Mn2+,SiO2以沉淀析出,然后向浸出液中先加双氧水,再加氯水,并调节溶液的pH到6,根据氢氧化物沉淀需要的pH,当pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,然后进一步精制,再利用离子交换膜电解。
(1)碳酸锰和稀硫酸反应生成硫酸锰,二氧化碳和水,离子方程式为MnCO3+2H+=Mn2++CO2↑+H2O;(2)加入双氧水时将亚铁离子氧化为铁离子,根据氢氧化物沉淀需要的pH知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,滤液中含有的阳离子为H+、Mn2+、Mg2+、NH4+;(3)酸性条件下,MnO2被亚铁离子还原,亚铁离子被氧化生成铁离子,所以在浸出液里锰元素只以锰离子的形式存在,且滤渣中无MnO2;(4)根据阴离子移动方向可知,左边电极是阴极,右边电极是阳极,则连接阴极的电极A是电源的负极,阳极上氢氧根离子放电生成氧气,电极反应为4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+;(5)锰离子不稳定,易被氧化生成二氧化锰,所以阳极的副反应为Mn2++2H2O-2e-=MnO2+4H+。
考点:物质分离和提纯的方法和基本操作综合应用、电解原理
点评:本题主要考查混合物的分离和提纯,侧重考查学生对知识的综合运用能力,涉及内容较多,难度较大。
本题难度:困难
3、选择题 pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.Na2SO4
B.H2SO4
C.AgNO3
D.NaOH
参考答案:A、电解硫酸钠溶液时,实际上电解的是水,所以溶液中氢离子和氢氧根离子的相对浓度不变,只是硫酸钠的浓度增大,故pH值不变,故A错误;
B、电解硫酸溶液时,实际上电解的是水,但溶液中氢离子的浓度增大,pH值减小,故B错误;
C、电解硝酸银溶液时,阴极上析出银,阳极上得到氧气,所以溶液中的氢氧根离子的浓度减小,氢离子的浓度增大,溶液的pH值减小,故C错误;
D、电解氢氧化钠溶液时,实际上电解的是水,但溶液中的氢氧根离子的浓度增大,氢离子的浓度减小,所以溶液的Pp值增大,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象。下列叙述正确的是
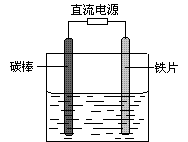
A.碳棒接直流电源的负极
B.碳棒上发生还原反应
C.铁片上的电极反应式为2Cl――2e- = Cl2↑
D.铁片附近出现的浑浊物是Mg(OH)2
参考答案:D
本题解析:因为在碳棒和铁片表面均有气体生成,且铁片附近出现浑浊现象,则说明溶液中少量的Mg2+与反应生成的OH-发生反应,则放出气体的反应式为2Cl――2e- = Cl2↑,2H2O+2e-═H2↑+2OH-。A、碳棒上发生的反应为2Cl――2e- = Cl2↑,接电源正极,故A错误;B、碳棒上发生的化学反应化合价升高是氧化反应,故B错误;C、铁片上的电极反应式为2H2O+2e-═H2↑+2OH-,故C错误;D、铁片附近的浑浊物为溶液中的Mg2+与OH-反应生成的沉淀,故D正确
本题难度:一般
5、选择题 下列说法正确的是
A.任何化学反应都可以设计成电解池反应
B.电镀铜和电解精炼铜时,电解质溶液中的c( Cu2+)均保持不变
C.电解冶炼镁、铝通常电解MgCl2和Al2O3,也可电解MgO和AlCl3
D.若把Cu+H2SO4 =CuSO4 +H2↑设计成电解池,应用Cu作阳极