微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据表中部分短周期元素的原子半径和主要化合价信息,判断以下叙述正确的是?
A.氢化物的沸点为:H2TB.L和Q形成的化合物中,两种微粒最外层均达到8电子稳定结构
C.单质的还原性顺序:LD.稳定简单离子半径的大小顺序为:L>T>R
参考答案:B
本题解析:考点:原子结构与元素周期率的关系.
分析:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,R有+6、-2价,可知R为S元素;Q有+7、-1价,则Q为氯元素;L、M只有正化合价,原子半径L>M>Q,则L为Na元素,M为Al元素.
A、水中存在氢键,沸点相对较高;
B、L和Q形成的化合物为氯化钠;
C、金属性越强,单质的还原性越强,同周期自左而右金属性减弱;
D、L、T的离子电子层排布相同,核电荷数越大离子半径越小,T、R离子最外层电子数相同,电子层越多离子半径越大.
解:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,R有+6、-2价,可知R为S元素;Q有+7、-1价,则Q为氯元素;L、M只有正化合价,原子半径L>M>Q,则L为Na元素,M为Al元素.
A、T为O元素,R为S元素;形成的氢化物水分子中存在氢键,沸点较高,故沸点H2T>H2R,故A错误;
B、L为Na元素,Q为氯元素;形成的化合物为氯化钠,氯化钠是离子化合物,由钠离子与氯离子构成,钠离子与氯离子最外层均达到8电子稳定结构,故B正确;
C、L为Na元素,M为Al元素,同周期自左而右金属性减弱,所以金属性Na>Al,金属性越强,单质的还原性越强,单质的还原性顺序:Na>Al,即L>M,故C错误;
D、L为Na元素,T为O元素,R为S元素;三者的简单离子分别为Na+、O2-、S2-,Na+、O2-电子层排布相同,核电荷数越大离子半径越小,所以Na+<O2-,O2-、S2-最外层电子数相同,电子层越多离子半径越大,所以O2-<S2-,所以离子半径Na+<O2-<S2-,即R>T>L,故D错误.
故选B.
本题难度:困难
2、简答题 四种短周期元素的微粒信息如下表:
| 元素代号 | Q | R | X | Z
微粒信息
离子: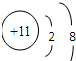
单质分子:R2
离子:X3+
一种原子:Z
|
已知Q、R、X在同一周期,R2常温常压下为气体
完成下列填空:
(1)Q位于周期表第______周期第______族.化合物Q2Z的电子式为______(用元素符号表示).
(2)Q、R、X的原子半径由大到小的顺序为______(用元素符号表示);Q、R、X、Z中金属性最强的是______(用元素符号表示).
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为:______.
参考答案:由四种短周期元素的微粒信息可知,Q的质子数为11,为Na;Z的质子数为8,则Z为O;Q、R、X在同一周期,且X为+3价,则X为Al;R2常温常压下为气体,R为Cl,
(1)Q位于第三周期第ⅠA族,化合物Q2Z的电子式为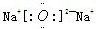 ,故答案为:三;ⅠA;
,故答案为:三;ⅠA;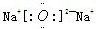 ;
;
(2)Q、R、X位于同周期,原子序数大的半径小,则原子半径由大到小的顺序为Na>Al>Cl,四种元素中只有Na、Al为金属,Na的金属性强,
故答案为:Na>Al>Cl;Na;
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为OH-+Al(OH)3=[Al(OH)4]-,故答案为:OH-+Al(OH)3=[Al(OH)4]-.
本题解析:
本题难度:一般
3、填空题 下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:?

(1)?f?元素在周期表中的位置是第____周期第____族。
(2)?e?与f?两元素最高价氧化物的水化物相互反应的化学方程式为____________________。
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4)?化合物ca3?的电子式为_________?,c和d两种元素氢化物的稳定性更强的是?_______(填物质的化学式)。
参考答案:(1)?3;IIIA?
(2)NaOH+Al(OH)3=NaAlO2+2H2O?
(3)?离子键;共价键?
(4)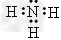 ;H2O
;H2O
本题解析:
本题难度:一般
4、选择题 同一主族的X?、?Y?、?Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4?,下列推断正确的是
A.原子序数: X<Y<Z
B.气态氢化物稳定性: XH3>YH3>ZH3
C.元素的非金属强弱: X>Y>Z
D.电子层数: X>Y>Z
参考答案:D
本题解析:同主族自上而下,随着原子序数的递增,非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,相应氢化物的稳定性逐渐减弱,所以根据题意可知非金属性是X<Y<Z,因此选项D是错误的,其余都是正确的,答案选D。
本题难度:一般
5、选择题 短周期的三种元素分别为X.Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是
[? ]
A.X2YZ4
B.XYZ3
C.X3YZ4
D.X4Y2Z7
参考答案:A
本题解析:
本题难度:一般