|
高中化学知识点总结《离子方程式的书写及正误判断》高频试题强化练习(2017年最新版)(二)
2017-09-25 18:34:33
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在学习中,我们经常应用类推法。下列左边正确,类推法应用于右边也正确的是
AA
| 向FeCl2溶液中滴入氯水
2Fe2++ Cl2= 2Fe3++ 2Cl—
| 向FeCl2溶液中滴入碘水
2Fe2++ I2= 2Fe3++2I—
| B
| CO2通入漂白粉溶液中
CO2+ Ca2++2ClO—+H2O=CaCO3↓+ 2HClO
| SO2通入漂白粉溶液中
SO2 +Ca2++2ClO—+H2O=CaSO3↓+2HClO
| C
| 向Na2CO3溶液中滴入稀HNO3
CO32—+ 2H+ = CO2↑+ H2O
| 向Na2SO3溶液中滴入稀HNO3
SO32— +2H+ = SO2↑+H2O
| D
| 向澄清石灰水中通入少量CO2气体
Ca2++2OH— +CO2= CaCO3↓+ H2O
| 向澄清石灰水中通入少量SO2气体
Ca2++2OH— +SO2= CaSO3↓+H2O
|
参考答案:D
本题解析:
试题解析:A.FeCl2溶液与碘水不反应,则前者发生氧化还原反应,后者不反应,与氧化性有关,故A错误;
B.SO2通入漂白粉溶液,发生氧化还原反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故B错误;
C.Na2SO3溶液中滴入稀HNO3发生氧化还原反应为2NO3-+3SO32-+2H+=3SO42-+2NO↑+H2O,故C错误;
D.二氧化碳、二氧化硫均为酸性氧化物,与碱反应均生成盐和水,则类推合理,故D正确。
考点:离子方程式的书写
本题难度:困难
2、选择题 下列反应对应的离子方程式书写正确的是
A.盐酸与氨水反应 H++OH- ==H2O
B.硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-==BaSO4↓+Cu(OH)2↓
C.硝酸银溶液中加入铜粉 Ag++Cu==Cu2++Ag
D.铁与稀盐酸反应 2Fe+6H+==2Fe3++3H2↑
|
参考答案:B
本题解析:一水合氨是弱电解质,离子方程式中应写成化学式的形式,A错误;硫酸铜中滴加氢氧化钡生成硫酸钡沉淀和氢氧化铜沉淀,B正确;离子方程式中电荷数不守恒,应该为 2Ag++Cu==Cu2++2Ag,C错误;铁与非氧化性酸反应生成亚铁离子,故D错误,答案选B。
考点:离子方程式书写
本题难度:一般
3、实验题 (16分)某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,草酸在常温下呈无色晶体状,其晶体的熔化温度低于草酸的分解温度,且易升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为____________________________________。
(2)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
①该实验说明草酸具有________(填“氧化”或“还原”)性,该反应的反应速率先慢后快的主要原因可能是_______ _ ______。
②请配平该反应的离子方程式:______MnO4-+____H2C2O4+____ ===____Mn2++____CO2↑+____。
(3)为了探究草酸的不稳定性,某同学设计了如下实验装置:
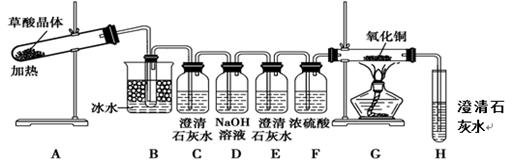
①C、H装置均变浑浊,E处无现象,G玻璃管里黑色变红色,写出A中反应的化学方程式: 。
②上述装置中,B装置的作用是 。 D的作用是 。从环境保护角度来看,该方案的不足之处是 。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为_______________(用离子符号表示)。
参考答案:(1)HCO3—+H2C2O4 =HC2O4—+CO2↑+H2O(3分)(2) ①还原性(1分)
反应产生的锰离子起催化作用或锰离子浓度增加,加快了反应速率(1分)
②256H+2108H2O(2分)(3)①H2C2O4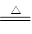 H2O +CO↑+CO2↑(3分) H2O +CO↑+CO2↑(3分)
②冷凝草酸蒸气,避免对二氧化碳的检验产生干扰(1分)
除去混合气体中的CO2 (1分) 没有尾气处理装置(1分)
(4)c(Na+)>c(HC2O4—)>c(H+)>c(C2O42—)>c(OH-)(3分)
本题解析:(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生,该气体是CO2,反应的离子方程式为HCO3—+H2C2O4 =HC2O4—+CO2↑+H2O。
(2)①溶液开始缓慢褪色,后来迅速变成无色,这说明高锰酸钾被还原,因此该实验说明草酸具有还原性。该反应的反应速率先慢后快,由于反应热效应不明显,这说明速率增大的原因是催化剂引起的,所以可能的原因是反应产生的锰离子起催化作用或锰离子浓度增加,加快了反应速率。
②反应中Mn元素的化合价从+7价降低到+2价,得到5个电子。碳元素的化合价从+3价升高到+4 价,失去1个电子,则根据电子得失守恒和原子守恒可知反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
(3)①C、H装置均变浑浊,这说明草酸分解有CO2产生。E处无现象,G玻璃管里黑色变红色,数目氧化铜被还原为金属铜,因此根据H中石灰水变浑浊可知草酸分解还有CO产生,所以A中反应的化学方程式为H2C2O4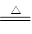 H2O +CO↑+CO2↑。 H2O +CO↑+CO2↑。
②由于草酸易挥发,能与石灰水反应,从而干扰CO2的检验,所以上述装置中,B装置的作用是冷凝草酸蒸气,避免对二氧化碳的检验产生干扰。为防止反应产生的CO2干扰CO的检验,需要氢氧化钠溶液吸收CO2,即D的作用是除去混合气体中的CO2。CO有毒,需要尾气处理,因此从环境保护角度来看,该方案的不足之处是没有尾气处理装置。
(4)2.52 g草酸晶体的物质的量=2.52g÷126g/mol=0.02mol,氢氧化钠的物质的量是0.1L×0.2mol/L=0.02mol,所以二者反应后恰好生成NaHC2O4。测得反应后溶液呈酸性,说明HC2O4—的电离程度大于HC2O4—的水解程度,所以形成的溶液中各离子的浓度由大到小的顺序为c(Na+)>c(HC2O4—)>c(H+)>c(C2O42—)>c(OH-)。
考点:考查氧化还原反应、外界条件大于反应速率的影响、气体检验以及溶液中离子浓度大小比较
本题难度:一般
4、填空题 (12分)
Ⅰ、按要求写出下列反应的方程式:
(1)碳酸氢铵与少量的氢氧化钠溶液反应(离子方程式) 。
(2)氯化铁溶液中通入二氧化硫气体(离子方程式) 。
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的反应(化学方程式) 。
(4)碘化亚铁和氯气以5:7的物质的量比反应(化学方程式) 。
Ⅱ、已知Fe2O3在高炉中有下列反应:Fe2O3+CO=2FeO+CO2,反应形成的固体混合物(Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
(1)上述固体混合物中,m(Fe):m(O)可能是 。
a.7:5 b.3:1 c.7:1
(2)设Fe2O3被CO还原的百分率为A%,则用含m(Fe)、m(O)的代数式表示A%的关系式为 。
参考答案:Ⅰ、(1)HCO3-+OH-=CO32-+H2O (2分) (2)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ (2分)
(3)KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O (2分) (4)5FeI2+7Cl2=4FeCl3+5I2+FeCl2(2分)Ⅱ、(1)b(2分) (2) 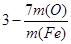 (2分) (2分)
本题解析:Ⅰ、(1)碳酸氢铵与少量的氢氧化钠溶液反应时氢氧根离子只与碳酸氢根离子反应,则反应的离子方程式为HCO3-+OH-=CO32-+H2O;
(2)铁离子具有氧化性,能氧化SO2,生成硫酸,则氯化铁溶液中通入二氧化硫气体反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 。
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的应该是硫酸根完全转化为硫酸钡沉淀,而此时铝离子恰好转化为偏铝酸盐,则反应的化学方程式为KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O。
(4)由于碘离子的还原性强于亚铁离子,因此氯气首先氧化碘离子,则碘化亚铁和氯气以5:7的物质的量比反应的化学方程式为5FeI2+7Cl2=4FeCl3+5I2+FeCl2。
Ⅱ、(1)如果固体中只有氧化铁,则m(Fe):m(O)=112:48=7:3;如果只有氧化亚铁,则m(Fe):m(O)=56:16=7:2,所以上述固体混合物中m(Fe):m(O)应该介于7:3与7:2之间,则可能是3:1,答案选b。
(2)如果假设反应前氧化铁是1mol,则根据Fe2O3被CO还原的百分率为A%可知,消耗CO是A%mol,即氧化铁失去氧原子的物质的量是A%mol,则m(Fe):m(O)=112:(48—16A%),解得A%=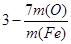 。 。
考点:考查方程式书写、混合物的有关计算
本题难度:困难
5、选择题 解释下列相应的实验事实方程式正确的是
A.稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H+十SO42-= BaSO4↓+H2O
B.测得0.1 mol/L氨水中C(OH-)为10-3 mol/L:NH3·H2O NH4++OH- NH4++OH-
C.在偏铝酸钠溶液中通入过量CO2出现白色沉淀:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓ + CO32-
D.碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+ Ca2+ + 2OH- = CaCO3↓+ CO32-+2H2O
|  NH4++OH-,正确;C、在偏铝酸钠溶液中通入过量CO2出现白色沉淀,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,错误;D、碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+Ca(OH)2=CaCO3↓+CO32-+2H2O,错误;故本题选择B。
NH4++OH-,正确;C、在偏铝酸钠溶液中通入过量CO2出现白色沉淀,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,错误;D、碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+Ca(OH)2=CaCO3↓+CO32-+2H2O,错误;故本题选择B。