|
高考化学知识点总结《化学平衡》高频试题特训(2017年最新版)(六)
2017-09-25 18:36:22
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应X(g)+Y(g)═2Z(g)(正反应为放热反应),在t1时达到平衡,t2时由于体系条件的改变,平衡受到破坏,到t3时再次达到平衡,如图为上述变化的物质的浓度与时间的关系,说明引起平衡移动的条件是( )
A.增大X或Y的浓度
B.增大压强
C.降低温度
D.升高温度
|
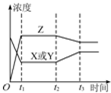
参考答案:A、由图可知,t2秒瞬间浓度都不变化,不可能是增大X或Y的浓度,且若增大了X或Y的浓度,平衡向正反应方向移动,Z的浓度应增大,不符合,故A错误;
B、增大了体系压强,平衡不移动,X、Y、Z的浓度应增大,故B错误;
C、该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象与实际不相符,故C错误;
D、该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象符合,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是(?)
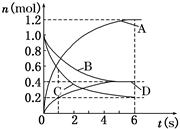
A.反应进行到6 s时,各物质的反应速率相等
B.反应进行到1 s时,v (A)=v (C)
C.反应进行到6 s时,B的平均反应速率为0.1 mol/(L·s)
D.该反应的化学方程式为3B+4 C 6A+2D 6A+2D
参考答案:D
本题解析:当反应进行到6s时,反应达到平衡状态,根据6s时反应物与生成物浓度可知反应的化学方程式为3B+4 C 6A+2D。A选项错误,到达6s时,各物质的反应速率之比与化学计量数之比相等。B选项错误,在1s时,A与C的物质的量相等。C选项错误,6s时B的平均反应速率为0.6mol/6s·2L = 0.05mol/(L·s)。D选项正确 6A+2D。A选项错误,到达6s时,各物质的反应速率之比与化学计量数之比相等。B选项错误,在1s时,A与C的物质的量相等。C选项错误,6s时B的平均反应速率为0.6mol/6s·2L = 0.05mol/(L·s)。D选项正确
本题难度:一般
3、选择题 某密闭容器中发生如下反应:X(g)+3Y(g)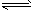 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
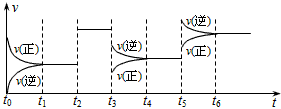
[? ]
A.t2时加入了正催化剂
B.t3时降低了温度
C.t5时增大了压强
D.在t4~t5时间内,X的转化率最低
参考答案:A
本题解析:
本题难度:一般
4、选择题 反应2A(g)?2B(g)+C(g);△H>0,达平衡后,要使v(正)降低、c(A)增大,应采取的措施是( )
A.降温
B.加催化剂
C.升温
D.加压
参考答案:A.降低温度,正逆反应速率都减小,平衡向逆反应方向移动,c(A)增大,故A正确;
B.加入催化剂,正逆反应速率均加快,化学平衡不会发生移动,故B错误;
C.升高温度,化学反应速率加快,平衡向正反应方向移动,c(A)减小,故C错误;
D.增大压强,平衡向逆反应方向移动,正逆反应速率都增大,故D错误;
故选A.
本题解析:
本题难度:一般
5、填空题 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: ___?C+?___?KMnO4+?____?H2SO4→____CO2↑+?____MnSO4?+?____K2SO4+?____H2O?
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据 CO2(g)+H2(g),得到如下三组数据
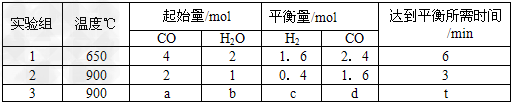
①实验1条件下平衡常数K=________(取小数二位,下同)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b?的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时
V正_____V逆(填“>”、“<”“=”)。
(3)已知在常温常压下:
①?2CH3OH(l)?+?3O2(g)?=?2CO2(g)?+?4H2O(g)?ΔH?=?-1275.6?kJ/mol
②?2CO?(g)+?O2(g)?=?2CO2(g)?ΔH?=?-566.0?kJ/mol
③?H2O(g)?=?H2O(l)?ΔH?=?-44.0?kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________
(4)为最近有科学家提出构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。该构想技术流程如下
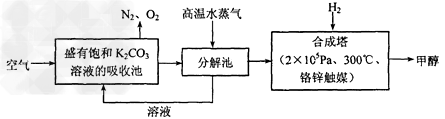
向分解池中通入高温水蒸气的作用是_______________________________
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L?,则生成沉淀所需CaCl2溶液的最小浓度为
__________。
参考答案:(1)_5_ C+ _4_ KMnO4+ _6_ H2SO4→5_CO2↑+ 4_MnSO4 + _2_K2SO4+ _6_H2O
(2)①2.67;②<1;③<
(3)CH3OH(l)+ O2(g) =CO(g) + 2H2O(l)?△H=﹣442.8 kJ/mol?
(4)提供高温环境使KHCO3分解
(5)5.6×10-5mo1/L
本题解析:
本题难度:一般
| 